题目内容
15.下列氧化还原反应中,水作为还原剂的是( )| A. | 3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
分析 水中O元素的化合价升高,则水作还原剂,以此来解答.
解答 解:A.水中H元素的化合价降低,水为氧化剂,故A不选;
B.水中H、O元素的化合价变化,只有N元素的化合价变化,故B不选;
C.只有过氧化钠中O元素的化合价变化,故C不选;
D.水中O元素的化合价升高,水为还原剂,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意常见元素化合价判断,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
5.通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能,键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的(△H)等于反应物的总键能与生成物的总键能之差.工业上通过下列反应制取氨气:N2(g)+3H2(g)?2NH3(g),根据表中化学键键能判断,该反应的△H为( )
| 化学键 | H-H | H-N | N═N |
| 键能/kJ•mol | 436 | 391 | 946 |
| A. | +1472kJ•mol-1 | B. | -1472kJ•mol-1 | C. | +92kJ•mol-1 | D. | -92kJ•mol-1 |
6.天然气、煤矿“瓦斯”、沼气的主要成分是( )
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 一氧化碳 |
10.下列有关元素性质比较正确的是( )
| A. | 氢化物稳定性:PH3>H2S>HCl | B. | 沸点:H2O>HF>HCl | ||
| C. | 原子半径:S>F>O | D. | 酸性:HClO>HNO3>H2CO3 |
7.下列说法正确的是( )
| A. | Na2O2与H2O反应过程中有离子键、非极性键、极性键的断裂和形成 | |
| B. | 1molNH4+中含有的共用电子对为3mol | |
| C. | N2属于单质,不存在化学键 | |
| D. | 离子化合物中一定含有金属元素 |
10.减少污染、保护环境是全世界最热门的课题.
Ⅰ.CO在催化剂作用下可以与H2反应生成甲醇:
①CO(g)+2H2(g)?CH3OH(g),△H1
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=-299kJ•mol-1.
(2)图1中能正确反映反应①平衡常数的对数lgK随反应温度T的变化曲线为Ⅰ (填曲线标记字母),其判断理由是反应为放热反应,升高温度,平衡逆向移动,平衡常数数值及平衡常数的对数lgK随温度升高变小.
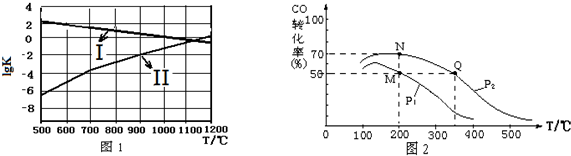
(3)在密闭容器中充有10mol CO与20mol H2,CO的平衡转化率与温度、压强的关系如图2.
①P1小于P2(填“大于”或“小于”),其判断理由是相同温度下,由于反应为气体分子数减小的反应,加压有利于平衡正移,提升CO的转化率,故P1<P2.
②M、N、Q三点平均速率ν(M)、ν(N)、ν(Q)大小关系为ν(M)<ν(N)<ν(Q).
③M、N、Q三点平衡常数KM、KN、KQ大小关系为KM=KN>KQ.
Ⅱ.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图3所示.已知:气体分压(P分)=气体总压(P总)×体积分数.
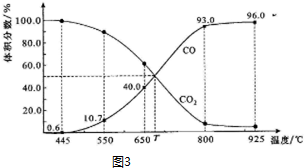
(1)完成下列填空:
①650℃时,反应达平衡后CO2的转化率为25.0%.
②T℃时,若充入等体积的CO2和CO,平衡不移动(填“向左移动”、“向右移动”或“不移动”)
③925℃时,P总=$\frac{1}{96}$MPa,用平衡分压代替平衡浓度表示的化学平衡常数KP=0.24 MPa.
Ⅰ.CO在催化剂作用下可以与H2反应生成甲醇:
①CO(g)+2H2(g)?CH3OH(g),△H1
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | 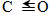 | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 876 | 465 | 413 |
(2)图1中能正确反映反应①平衡常数的对数lgK随反应温度T的变化曲线为Ⅰ (填曲线标记字母),其判断理由是反应为放热反应,升高温度,平衡逆向移动,平衡常数数值及平衡常数的对数lgK随温度升高变小.

(3)在密闭容器中充有10mol CO与20mol H2,CO的平衡转化率与温度、压强的关系如图2.
①P1小于P2(填“大于”或“小于”),其判断理由是相同温度下,由于反应为气体分子数减小的反应,加压有利于平衡正移,提升CO的转化率,故P1<P2.
②M、N、Q三点平均速率ν(M)、ν(N)、ν(Q)大小关系为ν(M)<ν(N)<ν(Q).
③M、N、Q三点平衡常数KM、KN、KQ大小关系为KM=KN>KQ.
Ⅱ.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图3所示.已知:气体分压(P分)=气体总压(P总)×体积分数.

(1)完成下列填空:
①650℃时,反应达平衡后CO2的转化率为25.0%.
②T℃时,若充入等体积的CO2和CO,平衡不移动(填“向左移动”、“向右移动”或“不移动”)
③925℃时,P总=$\frac{1}{96}$MPa,用平衡分压代替平衡浓度表示的化学平衡常数KP=0.24 MPa.