题目内容
14.W、X、Y、Z均为短周期主族元素,Y的原子序数是W和Z的原子序数之和的一半,Y原子的最外层电子数与核外电子总数之比为2:7;W和Z形成的可溶性化合物WZ溶于水不能促进水的电离;W、X、Z三种元素形成的某种化合物能消毒杀菌,下列说法正确的是( )| A. | 四种元素的原子中,原子半径最大的是Z | |
| B. | X、Y形成的化合物能溶于盐酸 | |
| C. | 1 mol W单质与足量X单质反应,转移的电子数为2NA | |
| D. | Z 的最高价氧化物对应水化物的酸性强于Y的最高价氧化物对应水化物的酸性 |
分析 Y原子的最外层电子数与核外电子总数之比为2:7,若最外层电子数为2,则核外电子总数为7,为N原子,最外层电子数为5,不满足题意;若最外层电子数为4,则核外电子总数为14,为硅元素,满足条件;若最外层电子数为6,最外层电子总数为42,该元素不是短周期元素;所以Y为Si;W和Z的原子序数之和为:14×2=28;W、X、Z三种元素形成的某种化合物能消毒杀菌,说明该化合物具有强氧化性,常见的具有强氧化性的物质中含有Cl、O;氯元素与氧元素的原子序数之和为25,不满足题意,如果W和Z中有一种为O,则另一种元素的原子序数为20,为Ca元素,不属于短周期;如果W和Z中有一种为Cl,则另一种为钠,W和Z形成的化合物为氯化钠,满足题意,所以Y为Si、X为O、W为Na、Z为Cl,据此进行解答.
解答 解:根据分析得出:X为O、Y为Si、Z为Cl、W为Na,
A.电子层多一般半径大,同周期序数越小半径越大,则四种原子中,Na的原子半径最大,即原子半径最大的是W,故A错误;
B.X为O、Y为硅,二者形成的化合物为二氧化硅,二氧化硅不溶于盐酸,故B错误;
C.W为钠,X为O,1mol钠与足量氧气完全反应失去了1mol电子,转移的电子数为NA,故C错误;
D.Z为Cl、Y为Si,二者非金属性大小为:Cl>Si,所以最高价氧化物对应的水化物酸性大小为:Z>Y,故D正确;
故选:D.
点评 本题为无机推断,侧重考查了原子结构相关知识,题目难度中等,明确原子结构及常见单质及其化合物性质是解答本题关键,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.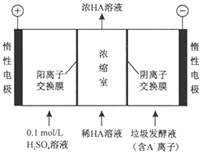 对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )
对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )
 对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )
对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液(含污染物乳酸跟离子)同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).下列叙述中正确的是( )| A. | 阴极区溶液的pH变小 | |
| B. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| C. | 通过一段时间后浓缩至水的量减少,导致乳酸溶液浓度上升 | |
| D. | 若阳、阴离子交换膜调换位置,与如图可以达到相同的效果 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | T℃时,pH=6的纯水中,含1×10-6NA个OH- | |
| B. | 标准状况下,1 L pH=13的氢氧化钡溶液中n(OH-)为0.1NA | |
| C. | 室温下,14.0 g乙烯和丁烯的混合气体中含有的C-H键数目为2.0NA | |
| D. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L |
2.化学与生产、生活、社会密切相关.下列说法中正确的是( )
| A. | 煤的液化是物理变化 | |
| B. | 纤维素水解产物可以通过一系列化学变化制乙醇 | |
| C. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| D. | 漂白粉长期放置会被空气中的氧气氧化而变质 |
9.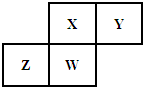 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是内层电子数的三倍.下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是内层电子数的三倍.下列说法不正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是内层电子数的三倍.下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是内层电子数的三倍.下列说法不正确的是( )| A. | Y元素与氢元素可形成H2Y2型的离子化合物 | |
| B. | Z元素的单质有半导体特性,原子半径:Z>X | |
| C. | 最高价氧化物对应水化物的酸性:HXO3>H3WO4 | |
| D. | 元素Z、W的最高正价分别与其主族序数相等 |
19.五种短周期元素的某些性质如下所示,有关说法不正确的是( )
| 元素 | 元素的相关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 原子的M电子层上有3个电子 |
| C | 在短周期主族元素中,其原子半径最大 |
| D | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反 应生成D的单质和H2O |
| E | 元素最高正价与最低负价的代数和为6 |
| A. | A的气态氢化物具有还原性,常温下,该氢化物水溶液的pH>7 | |
| B. | C单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 在B和E所形成的化合物中存在离子键 | |
| D. | C与D可形成不同原子或离子个数比的化合物 |
6.下列有关化学用语表示正确的是( )
| A. | 羟基的电子式: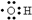 | B. | 淀粉和纤维素的实验式:CH2O | ||
| C. | CH4分子的球棍模型: | D. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C |
3.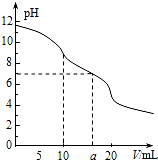 常温下,用 0.1mol•L-1 HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L-1 HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
 常温下,用 0.1mol•L-1 HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L-1 HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(CO32-)>c(HCO3-)>c(OH-)>c(H2CO3) | |
| B. | 当V=5时:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) | |
| C. | 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
1.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面说法错误的是( )
| A. | 能够节约原料和能源 | B. | 能提高产品的产量 | ||
| C. | 能够提高化学反应速率 | D. | 能够提高经济效益 |