题目内容
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | T℃时,pH=6的纯水中,含1×10-6NA个OH- | |
| B. | 标准状况下,1 L pH=13的氢氧化钡溶液中n(OH-)为0.1NA | |
| C. | 室温下,14.0 g乙烯和丁烯的混合气体中含有的C-H键数目为2.0NA | |
| D. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L |
分析 A.水的体积不知不能计算氢氧根离子数;
B.、依据PH=13,离子积常数不是常温下的10-14,依据水的电离平衡分析应小于常温下离子积常数;
C.乙烯和丁烯最简式相同为CH2,计算14.0gCH2中含有的C-H数;
D.温度压强不知不能计算气体体积;
解答 解:A.pH=6的纯水中只能知道氢氧根离子浓度为10-8mol/L,体积不知不能计算氢氧根离子数,故A错误;
B.依据PH计算氢氧根离子浓度=$\frac{Kw}{c({H}^{+})}$,离子积常数不是常温下的10-14,故B错误;
C.乙烯和丁烯最简式相同为CH2,计算14.0gCH2中含有的C-H数=$\frac{14g}{14g/mol}$×2×NA=2.0NA,故C正确;
D.标准状况下0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L,温度压强不知不能计算气体体积,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是离子浓度、离子积常数、化学键数目、气体摩尔体积条件应用等知识点,题目难度中等.

练习册系列答案
相关题目
5.下列说法正确的是( )
①甲酸乙酯、乙酸甲酯、丙酸互为同分异构体
②甲醛、乙酸、甲酸甲酯三种有机化合物的碳氢氧的质量比相同
③RCOOH与R′0H发生脂化反应时生成ROCOR′
④能与NaOH溶液发生反应,分子式为C2H4O2的有机化合物一定是羧酸.
①甲酸乙酯、乙酸甲酯、丙酸互为同分异构体
②甲醛、乙酸、甲酸甲酯三种有机化合物的碳氢氧的质量比相同
③RCOOH与R′0H发生脂化反应时生成ROCOR′
④能与NaOH溶液发生反应,分子式为C2H4O2的有机化合物一定是羧酸.
| A. | ①③ | B. | ②④ | C. | ①② | D. | ①②④ |
16.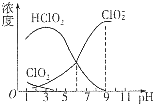 亚氯酸钠(NaClO2)是一种高效漂白剂.在NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列说法错误的是( )
亚氯酸钠(NaClO2)是一种高效漂白剂.在NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列说法错误的是( )
 亚氯酸钠(NaClO2)是一种高效漂白剂.在NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列说法错误的是( )
亚氯酸钠(NaClO2)是一种高效漂白剂.在NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列说法错误的是( )| A. | 亚氯酸钠溶液在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| C. | 使用该漂白剂的最佳pH约为4 | |
| D. | 25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合(pH=5.1),则混合溶液中有c(HClO2)+c(H+)=c(ClO${\;}_{2}^{-}$)+c(OH-) |
13.如图装置进行相关实验能实现目的是( )
| I中试剂 | II中试剂 | 目的 | 装置 | |
| A | 澄清石灰水 | 足量酸性KMnO4溶液 | 检验SO2中是否混合有CO2 | 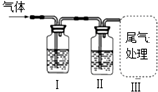 |
| B | 溴水 | NaOH溶液 | 除去CH4中混有的C2H4气体 | |
| C | 饱和Na2CO3溶液 | 浓硫酸 | 除去CO2中混有HCl气体 | |
| D | 澄清石灰水 | CuSO4溶液 | 证明混合气体中含有CO2和H2O气体. |
| A. | A | B. | B | C. | C | D. | D |
20.下列说法正确的是( )
| A. | 在H+的作用下,溶液中黄色的CrO42-能被氧化为橙红色的Cr2O72- | |
| B. | 7.8 gNa2O2完全反应一定转移了0.1mol电子 | |
| C. | 只用溴水可鉴别出苯、四氯化碳、乙醇、乙醛、环己烯五种无色液体 | |
| D. | 常温下,NH4Cl和NH3•H2O混合的溶液pH一定大于7 |
14.W、X、Y、Z均为短周期主族元素,Y的原子序数是W和Z的原子序数之和的一半,Y原子的最外层电子数与核外电子总数之比为2:7;W和Z形成的可溶性化合物WZ溶于水不能促进水的电离;W、X、Z三种元素形成的某种化合物能消毒杀菌,下列说法正确的是( )
| A. | 四种元素的原子中,原子半径最大的是Z | |
| B. | X、Y形成的化合物能溶于盐酸 | |
| C. | 1 mol W单质与足量X单质反应,转移的电子数为2NA | |
| D. | Z 的最高价氧化物对应水化物的酸性强于Y的最高价氧化物对应水化物的酸性 |
15.施多宁适用于与其他抗病毒药物联合治疗HIV-1感染的成人、青少年及儿童.下列叙述正确的是( )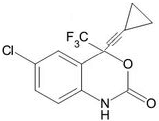

| A. | 该化合物中含有1个手性碳原子 | |
| B. | 该有机化合物分子式为:C14H8ClF3NO2 | |
| C. | 该化合物能发生水解、加成、氧化和消去反应 | |
| D. | 1mol该化合物与足量H2 反应,最多消耗5mol H2 |
 .
. .
.
 (标明配位键);其中Al的杂化方式是sp3.(相对原子质量:Al-27;Cl-35.5)
(标明配位键);其中Al的杂化方式是sp3.(相对原子质量:Al-27;Cl-35.5)