题目内容
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=-185kJ/molE(H-H)=436kJ/mol E(Cl-Cl)=243kJ/mol则E(H-Cl)=
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
2Cu(s)+O2(g)═2CuO(s)△H=-314kJ?mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
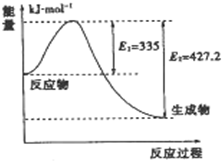
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为:
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为
考点:用盖斯定律进行有关反应热的计算,燃烧热,热化学方程式
专题:
分析:(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(2)依据反应焓变=反应物键能总和-生成物键能总和计算得到;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)①依据图象分析,生成2mol氨气反应焓变=断裂化学键吸收能量-形成化学键放出能量计算得到1mol氨气放出热量;
②依据化学平衡计算生成氨气物质的量,结合热化学方程式计算Q1,若在同体积的容器中充入2mol N2和6mol H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行计算分析达平衡后放出的热量为Q2 kJ.
(2)依据反应焓变=反应物键能总和-生成物键能总和计算得到;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)①依据图象分析,生成2mol氨气反应焓变=断裂化学键吸收能量-形成化学键放出能量计算得到1mol氨气放出热量;
②依据化学平衡计算生成氨气物质的量,结合热化学方程式计算Q1,若在同体积的容器中充入2mol N2和6mol H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行计算分析达平衡后放出的热量为Q2 kJ.
解答:
解:(1)在25℃、101kPa下,16g甲醇(CH3OH)燃烧生成CO2和液态水时放热352kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为704KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-704kJ?mol-1,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-704kJ?mol-1;
(2)焓变△H=反应物键能总和-生成物键能总和,H2 (g)+Cl2 (g)=2HCl (g)△H=-185kJ/mol,E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol,
E(H-H)+E(Cl-Cl)-2E(H-Cl)=△H,
则E(H-Cl)=432 kJ/mol;
故答案为:432 kJ/mol;
(3)①2Cu(s)+
O2(g)═Cu2O(s)△H=-169kJ?mol-1,
②C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1,
③2Cu(s)+O2(g)═2CuO(s)△H=-314kJ?mol-1
依据盖斯定律①+②-③得到工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5 KJ/mol;
故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5 KJ/mol;
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,所以生成1mol氨气放热46.1KJ;
故答案为:46.1 kJ;
②如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,
N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol
1 3 0
0.2 0.6 0.4
生成0.4mol氨气放热=
×92,2KJ=18.44KJ;
若在同体积的容器中充入2mol N2和6mol H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行达平衡后放出的热量Q2 大于2Q1;
故答案为:18.44,>;
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)焓变△H=反应物键能总和-生成物键能总和,H2 (g)+Cl2 (g)=2HCl (g)△H=-185kJ/mol,E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol,
E(H-H)+E(Cl-Cl)-2E(H-Cl)=△H,
则E(H-Cl)=432 kJ/mol;
故答案为:432 kJ/mol;
(3)①2Cu(s)+
| 1 |
| 2 |
②C(s)+
| 1 |
| 2 |
③2Cu(s)+O2(g)═2CuO(s)△H=-314kJ?mol-1
依据盖斯定律①+②-③得到工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5 KJ/mol;
故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5 KJ/mol;
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,所以生成1mol氨气放热46.1KJ;
故答案为:46.1 kJ;
②如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,
N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol
1 3 0
0.2 0.6 0.4
生成0.4mol氨气放热=
| 0.4mol |
| 2mol |
若在同体积的容器中充入2mol N2和6mol H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行达平衡后放出的热量Q2 大于2Q1;
故答案为:18.44,>;
点评:本题考查了热化学方程式和盖斯定律的计算应用,反应键能计算费用焓变,图象分析理解,注意反应焓变的意义理解,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
如图是X、Y两种固体物质的溶解度曲线,下列说法不正确的是( )
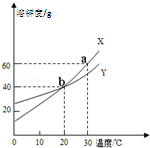

| A、将20℃的饱和溶液X降温到10℃,溶液X仍然是饱和溶液 |
| B、a点表示30℃时,X的溶解度为60g |
| C、b点表示20℃时,X、Y的溶解度相等 |
| D、同质量的X、Y饱和溶液分别从30℃降到10℃时,析出的Y的质量大于X的质量 |
下列离子方程式正确的是( )
| A、澄清的石灰水与盐酸反应 Ca(OH)2+2H+═Ca2++2H2 O |
| B、钠与水的反应 Na+2H2 O═Na++2OH-+H2↑ |
| C、铜片插入硝酸银溶液 Cu+Ag+═Cu2++Ag |
| D、大理石溶于醋酸 CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
分子是构成物质的一种粒子.走近鲜饼屋,能闻到香味,这是因为( )
| A、分子是不断运动的 |
| B、分子能保持物质的化学性质 |
| C、分子之间有间隙 |
| D、分子是由原子构成的 |
已知A(g)+B(g)═C(g)△H1,D(g)+B(g)═E(g)△H2.若A和D混合气体1mol与B完全反应,反应热为△H3,则A和D物质的量之比为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
已知:①2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1;
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1.
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1.
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
| A、262.6 kJ?mol-1 |
| B、-131.3 kJ?mol-1 |
| C、-352.3 kJ?mol-1 |
| D、131.3 kJ?mol-1 |
当Mg(OH)2在水中达到溶解平衡时:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是( )
| A、NH4Cl |
| B、NaOH |
| C、Na2CO3 |
| D、Fe |
已知:C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1①
C(s)+O2(g)═CO2(g)△H=-393.51kJ?mol-1②
计算反应C(s)+CO2(g)═2CO(g)的反应热△H的值为( )
| 1 |
| 2 |
C(s)+O2(g)═CO2(g)△H=-393.51kJ?mol-1②
计算反应C(s)+CO2(g)═2CO(g)的反应热△H的值为( )
| A、-283.01kJ?mol-1 |
| B、+172.51kJ?mol-1 |
| C、+283.1kJ?mol-1 |
| D、+504.00kJ?mol-1 |