题目内容
7.将100mL0.3mol•L-1的NaHSO4溶液和100mL0.2mol•L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程式:3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O;若向反应后的溶液中滴加2~3滴酚酞试液,则溶液的颜色变为红色.分析 n(NaHSO4)=0.1L×0.3mol/L=0.03mol/L,n[Ba(OH)2]=0.1L×0.2mol/L=0.02mol,Ba2+完全反应,生成硫酸钡、水、NaOH,反应后溶液显碱性,据此进行解答.
解答 解:100mL0.3mol•L-1的NaHSO4溶液中含有硫酸氢钠的物质的量为:n(NaHSO4)=0.1L×0.3mol/L=0.03mol/L,
100mL0.2mol•L-1的Ba(OH)2溶液中含有氢氧化钡的物质的量为:n[Ba(OH)2]=0.1L×0.2mol/L=0.02mol,
则Ba2+完全反应,生成硫酸钡、水、NaOH,反应的离子反应为:3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O,
反应后溶液显碱性,滴加2~3滴酚酞试液,则溶液的颜色变为红色,
故答案为:3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O;红色.
点评 本题考查了离子方程式的书写,题目难度不大,根据反应物过量情况正确判断生成物为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
17.下列关于元素周期表的结构、性质和用途叙述正确的是( )
| A. | 过渡元素一定是金属元素 | |
| B. | 根据构造原理、泡利原理等核外电子排布规律可预测未来的第八周期包括的元素的种类有64个 | |
| C. | 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻 | |
| D. | 原子最外层电子数为2的元素一定是 IIA元素 |
18.能使H2O+H2O≒H3O++OH-的电离平衡向电离方向移动,但所得溶液仍呈中性的是( )
| A. | 加入硫酸 | B. | 加入少量氯化铵晶体 | ||
| C. | 继续加水 | D. | 升温 |
15.已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判断溶液呈中性的依据是( )
| A. | a=b | B. | 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) | ||
| C. | 混合溶液中,c(H+)=√Kw | D. | 混合溶液的pH=7 |
12.对于下列物质中划线元素化合价分析错误的是( )
| A. | K2$\stackrel{+6}{Mn}$O4 | B. | Na2$\stackrel{+4}{S}$O3 | C. | H$\stackrel{+5}{C}$O3- | D. | $\stackrel{-3}{N}$H4+ |
19.常温下,在下列溶液中可能大量共存的离子组是( )
| A. | pH=0的溶液:Fe2+、Mg2+、NO3-、SO42- | |
| B. | 由水电离出的c(H+)=1×10-13mol/L的溶液:Al3+、K+、SO42-、Cl- | |
| C. | $\frac{c({OH}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | pH=14的溶液:Na+、K+、Al3+、CO32- |
17.将物质的量均为0.1molK2SO4和Al2(SO4)3溶于水,向其中加入一定量的Ba(OH)2溶液,测得铝元素有一半留在溶液中,则生成BaSO4的物质的量可能为( )
| A. | 0.25mol | B. | 0.30mol | C. | 0.35mol | D. | 0.4mol |

 其基态原子核外有26种不同电子运动状态;
其基态原子核外有26种不同电子运动状态;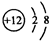 ,S2-的结构示意图
,S2-的结构示意图 .
.