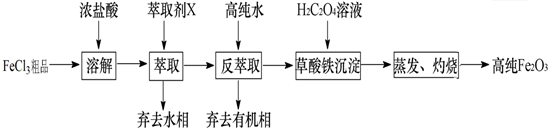
题目内容
17.有一种化学式为R(NO3)x•n(H2O)的硝酸盐晶体,现取此晶体6.05g溶于水配成500mL溶液,用石墨棒作为电极材料对此溶液进行电解,当通过电流为5A时,经16.05min后,溶液中的金属离子恰好全部放电,且其中一极增重1.60g(已知此晶体的摩尔质量为242g/mol),则:(1)R的原子量为64;
(2)X=2;
(3)n=5;
(4)若反应前后体积不变,反应后溶液的pH=1.注意:请简要写出全部计算的过程.
分析 当通过电流为5A时,经16.05min后,时间16.05×60=963s,I=$\frac{q}{t}$,5=$\frac{q}{963}$,q=963×5=eN e=1.6×10-19,
n=$\frac{N}{{N}_{A}}$=$\frac{\frac{963×5}{1.6×1{0}^{-19}}}{6.02×1{0}^{23}/mol}$=0.05mol,
(1)阴极析出金属单质,盐的物质的量=$\frac{6.05g}{242g/mol}$=0.025mol,根据原子守恒知,n(R)=0.025mol,根据M=$\frac{m}{n}$计算R摩尔质量,摩尔质量在数值上等于其相对原子质量;
(2)根据阴阳离子所带电荷相等确定X值;
(3)根据水的质量与物质的量的关系计算n;
(4)依据电解方程式根据M的物质的量求出氢离子的物质的量,然后求pH.
解答 解:当通过电流为5A时,经16.05min后,时间16.05×60=963s,I=$\frac{q}{t}$,5=$\frac{q}{963}$,q=963×5=eN e=1.6×10-19,
n=$\frac{N}{{N}_{A}}$=$\frac{\frac{963×5}{1.6×1{0}^{-19}}}{6.02×1{0}^{23}/mol}$=0.05mol,
(1)阴极析出金属单质,盐的物质的量=$\frac{6.05g}{242g/mol}$=0.025mol,根据原子守恒知,n(R)=0.025mol,根据M=$\frac{m}{n}$=$\frac{1.60g}{0.025mol}$=64g/mol,摩尔质量在数值上等于其相对原子质量为64,故答案为:64;
(2)该元素是Cu元素,该化合物中化合价为+2价,根据阴阳离子所带电荷相等知,X为2,故答案为:2;
(3)该硝酸盐的物质的量为0.025mol,则水的物质的量为0.025nmol=$\frac{6.05g-0.025mol×188g/mol}{18g/mol}$=0.075mol,n=5,故答案为:5;
(4)溶液中电解离子方程式为:2M2++2H2O$\frac{\underline{\;电解\;}}{\;}$2M+O2↑+4H+;
根据金属单质与氢离子关系式知,n(H+)=2n(R)=2×0.025mol=0.05mol;
所以c(H+)=$\frac{0.05mol}{0.5L}$=0.1mol/L,则pH=1,
故答案为:1.
点评 本题考查电解原理,为高频考点,属于跨学科习题,正确计算转移电子物质的量是解本题关键,侧重考查学生分析计算能力,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案Ⅰ、他们先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜.
(1)如果直接用铜屑与稀硝酸反应来制取硝酸铜:
1铜屑与稀硝酸反应的化学反应方程式为3Cu+8HNO3═3Cu(NO3)3+NO↑+4H2O;
②可能导致的两个不利因素是成等物质的量的硝酸铜,消耗硝酸原料多、且产生污染物氮氧化物.
(2)实验中,欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序是蒸发浓缩、冷却结晶、过滤、晾干.
Ⅱ、为了探究Cu(NO3)2在酸性条件下跟铁单质的反应.他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质.
(3)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验.请按下表格式补充写出实验操作步骤、预期现象与结论.
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,①不能(填“能”或“不能”)确定产物中铁元素的价态 |
| 步骤2:取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素,若KMnO4溶液不褪色或不变浅,则说明产物中不含+2价铁元素 |
| 步骤3:③另取少量溶液,滴加KSCN溶 | ③若溶液变为红色,说明产物中含+3价铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
| A. | 熵增加且放热的反应一定是自发反应 | |
| B. | X?Y+Z正反应吸热,则逆反应必然放热 | |
| C. | 化学反应的焓变△H越大,表示放热越多 | |
| D. | 稀溶液中,酸碱中和反应生成1 mol H2O时放热不一定为57.3 kJ |
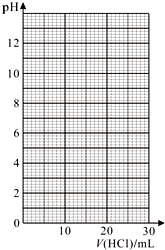 化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:(1)配制待测液:用分析天平准确称取烧碱样品2.500 g,全部溶于水配制成500 mL溶液.配制溶液需用的玻璃仪器除了烧杯、胶头滴管外,还需要500mL容量瓶、量筒.
(2)滴定:
①用碱式滴定管量取20.00mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测.滴定管在装入反应液之前应进行的操作有检查滴定管是否漏水,洗净并用待盛装的溶液润洗滴定管2~3次.
②用浓度为0.100 0mol/L的盐酸标准溶液进行滴定.开始滴定前的一步操作是调节液面于“0”刻度或“0”刻度以下.
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时每滴一滴测一次pH.滴定过程中,测得锥形瓶中溶液的pH变化如下表:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 |
| V(HCl)/mL | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 | |
| pH | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
①在坐标图中绘出上述中和滴定曲线.
②所测样品中NaOH的质量百分含量为96%.
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 0.01mol/L | B. | 0.1mol/L | C. | 1mol/L | D. | 10mol/L |