题目内容
9.下列两种溶液混合后,所得溶液中各离子浓度关系不正确的是( )| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
分析 A.反应后溶质为醋酸钠,醋酸根离子的水解程度较小,则c(CH3COO-)>c(OH-);
B.醋酸为弱酸,混合液中醋酸过量,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知c(CH3COO-)>c(Na+);
C.溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知c(CH3COO-)=c(Na+);
D.根据混合液中的电荷守恒判断.
解答 解:A.0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合,恰好反应生成醋酸钠,醋酸根离子部分水解,溶液呈碱性,溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A错误;
B.常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合,醋酸为弱酸,混合液中醋酸过量,溶液呈酸性,则c(H+)>c(OH-),根据核电荷数可知:c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,则c(H+)=c(OH-),根据电荷守恒可知c(CH3COO-)=c(Na+),溶液中离子浓度大小为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),故C正确;
D.0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合,根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故D正确;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的灵活应用能力.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案| A. | K+、Ca2+、Cl-、CO32- | B. | Fe2+、Al3+、NO3-、SO42- | ||
| C. | Mg2+、NH4+、CO32-、H+ | D. | Na+、Br-、ClO-、H+ |
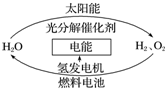 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )| A. | 氢能源已被普遍使用 | |
| B. | H2O的分解反应是吸热反应 | |
| C. | 氢气不易贮存和运输,无开发利用价值 | |
| D. | 2 mol 液态H2O具有的总能量高于2 mol H2和1 mol O2的能量 |
| A. | 1×10-11mol/L | B. | 1×10-3mol/L | C. | 1×10-7mol/L | D. | 0.1mol/L |
| A. | 电解质 | B. | 碳酸盐 | C. | 钠盐 | D. | 碱 |
| A. | 凡含有食品添加剂的食物对人体健康均有害,不宜食用 | |
| B. | 废弃的塑料,金属、纸制品及玻璃都是可回收再利用的资源 | |
| C. | 大气污染物SO2、CO和NO2主要来源于煤的燃烧和汽车排放的尾气 | |
| D. | 变质的油脂有难闻的特殊气味,是由于油脂发生了化学变化 |
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑩ | ⑧ | |||
| 第4周期 | ② | ④ | ⑨ |
(2)⑧和⑨两元素的核电荷数之差为18
(3)元素⑦的一种氢化物常温下和元素②的单质反应的化学方程式为2K+H2O=2KOH+H2↑;若该氢化物和元素⑧的单质反应,则化学方程式为Cl2+H2O=HCl+HClO
(4)①和⑨两元素形成化合物的化学式为NaBr;该化合物灼烧的焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为Cl2+2NaBr=2NaCl+Br2.