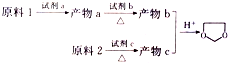
题目内容
11.分子式为C9H10O2,结构中含有苯环和一个链状支链,且能与NaOH溶液反应,该有机化合物的结构有(不考虑立体异构)( )| A. | 2种 | B. | 6种 | C. | 7种 | D. | 8种 |
分析 分子式为C9H10O2,结构中含有苯环和一个链状支链,且能与NaOH溶液反应,说明含有丙酸基或酯基,结合取代基的不同分析同分异构体.
解答 解:分子式为C9H10O2,结构中含有苯环和一个链状支链,且能与NaOH溶液反应,说明含有丙酸基或酯基,
取代基为正丙酸基时,1种结构,取代基为异丙酸基,1种结构,共有2种结构,
取代基为酯基,取代基有:-OOCCH2CH3、-CH2OOCCH3、-CH2CH2OOCH、-CH(CH3)OOCH、-COOCH2CH3、-CH2COOCH3,共有6种结构,
所以该有机化合物的结构有8种,故选D.
点评 本题考查同分异构体的书写,题目难度不大,判断取代基是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A. | Y、Z两元素形成的简单阴离子的还原性Z>Y | |
| B. | 原子半径大小的顺序为Z>X>Y>W | |
| C. | X与W形成的化合物W2X2中含有离子键和共价键 | |
| D. | Y、Z两种元素最高价氧化物的水化物的酸性Z>Y |
19.下列说法不正确的是( )
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 乙醇的酯化反应和酯的水解均属于取代反应 | |
| C. | 乙醇、乙酸均可与金属钠反应 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
1. 25℃时,三种酸的电离平衡常数如下:
25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka增大(填“增大”、“减小”或“不变”).
(2)下列四种离子结合质子能力由大到小的顺序是a>b>d>c(填序号);
a.CO32-b.ClO- c.CH3COO-d.HCO3-
(3)下列反应不能发生的是cd(填序号)
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是b(填序号);
a.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$b.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ c.$\frac{c({H}^{+})}{{k}_{W}}$ d.$\frac{c({H}^{+})}{c(O{H}^{-})}$
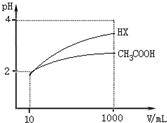
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示.
则HX的电离平衡常数大于(填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+),理由是稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱;
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确数值).
 25℃时,三种酸的电离平衡常数如下:
25℃时,三种酸的电离平衡常数如下:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)一般情况下,当温度升高时,Ka增大(填“增大”、“减小”或“不变”).
(2)下列四种离子结合质子能力由大到小的顺序是a>b>d>c(填序号);
a.CO32-b.ClO- c.CH3COO-d.HCO3-
(3)下列反应不能发生的是cd(填序号)
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是b(填序号);
a.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$b.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ c.$\frac{c({H}^{+})}{{k}_{W}}$ d.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示.
则HX的电离平衡常数大于(填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+),理由是稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱;
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确数值).
 ,G可用作工业增塑剂.回答下列问题:
,G可用作工业增塑剂.回答下列问题: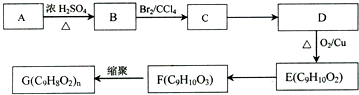
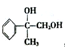
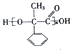 ,已知A的一种同分异构体也能转化为B,则该同分异构体的结构简式为
,已知A的一种同分异构体也能转化为B,则该同分异构体的结构简式为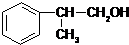 .
.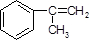 +Br2→
+Br2→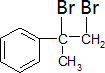 .
.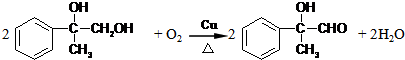 .
. .
.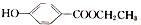 )是一种常用的食品添加剂,合成路线如下:
)是一种常用的食品添加剂,合成路线如下: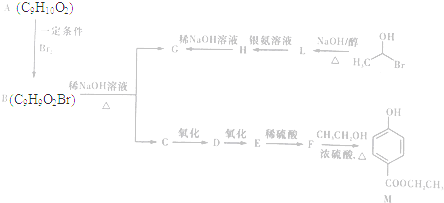
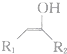 $\stackrel{不稳定、自动转化}{→}$
$\stackrel{不稳定、自动转化}{→}$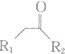 (R1、R2为H或烃基)
(R1、R2为H或烃基) 与稀氢氧化钠溶液不反应
与稀氢氧化钠溶液不反应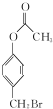 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$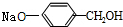 +CH3COONa+H2O+NaBr;
+CH3COONa+H2O+NaBr;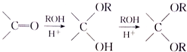 由乙烯、甲醇为有机原料制备化合物
由乙烯、甲醇为有机原料制备化合物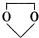 的合成路线流程图(无机试剂任选)如下:
的合成路线流程图(无机试剂任选)如下: