题目内容
10.以下电子排布式表示基态原子电子排布的是( )| A. | 1s22s22p63s13p3 | B. | 1s22s22p63s23p63d104s14p1 | ||
| C. | 1s22s22p63s23p63d24s2 | D. | 1s22s22p63s23p63d104s14p2 |
分析 A.先排满3s轨道,再排3p轨道;
B.先排满4s轨道,再排4p轨道;
C.电子填充顺序依次为1s2s2p3s3p3d4s;
D.先排满4s轨道,再排4p轨道.
解答 解:A.Si原子核外电子数为14,先排满3s轨道,再排3p轨道,核外电子排布式为:1s22s22p63s23p2,故A错误;
B.Zn原子核外30个电子,先排满4s轨道,再排4p轨道,核外电子排布式为:1s22s22p63s23p63d104s2,故B错误;
C.Ti原子核外22个电子,电子填充顺序依次为1s2s2p3s3p3d4s,则核外电子排布式为:1s22s22p63s23p63d24s2,故C正确;
D.Ga原子核外31个电子,先排满4s轨道,再排4p轨道,则核外电子排布式为:1s22s22p63s23p63d104s24p1,故D错误.
故选C.
点评 本题考查了原子核外电子排布,根据基态原子排布规律来分析解答即可,题目难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列有关实验存在不合理的装置是( )
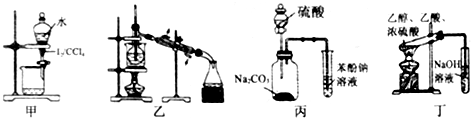

| A. | 装置甲:用CCl4萃取碘水中的碘 | |
| B. | 装置乙:加热碘的CCl4溶液,分离碘并回收CCl4 | |
| C. | 装置丙:验证硫酸、碳酸、苯酚溶液的酸性 | |
| D. | 用乙酸、乙醇制取乙酸乙酯 |
1.只用胶头滴管和试管,不能区别的溶液是( )
| A. | 稀盐酸和Na2CO3 | B. | 稀盐酸和Na[Al(OH)4] | C. | CaCl2和Na2CO3 | D. | NaOH和AlCl3 |
18.下列各组微粒中,半径前者小于后者的是( )
| A. | C、O | B. | N、P | C. | Mg、Al | D. | Na、Na+ |
5.下列分子中,属于非极性的是( )
| A. | SO2 | B. | BeCl2 | C. | PBr3 | D. | COCl2 |
15.下列含有共价键的离子化合物是( )
| A. | MgCl2 | B. | Na2O2 | C. | H2O2 | D. | NaCl |
2.对于锂、钠、钾、铷、铯五种元素的单质或化合物的说法不正确的是( )
| A. | 随着电子层数的增加单质的密度逐渐升高 | |
| B. | 随着核电荷数的增加单质的熔点逐渐降低 | |
| C. | 在自然界中都只能以化合态形式存在 | |
| D. | 单质都能与水反应,且反应后的溶液都呈碱性 |
20.下列表达式中错误的是( )
| A. | 过氧化氢的电子式: | B. | S2-的结构示意图: | ||
| C. | 氟化钙的电子式: | D. | CO2分子的结构式:O=C=O |