题目内容
15.下列含有共价键的离子化合物是( )| A. | MgCl2 | B. | Na2O2 | C. | H2O2 | D. | NaCl |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,据此分析解答.
解答 解:A.氯化镁中镁离子和氯离子之间只存在离子键,为离子化合物,故A错误;
B.Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键,为离子化合物,故B正确;
C.H2O2中存在H-O、O-O共价键,属于共价化合物,故C错误;
D.NaCl中只有离子键,故D错误;
故选B.
点评 本题考查化学键、化合物类型判断,侧重考查基本概念,明确物质构成微粒是解本题关键,注意化合物和化学键的关系,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
6.短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | W得电子能力比Q强 | |
| B. | Z的氧化物能与水直接化合生成对应的酸 | |
| C. | 钠与Y可能形成的两种常见化合物阴阳离子个数比均为1:2 | |
| D. | X有多种同素异形体,而Y不存在同素异形体 |
3.下列说法中正确的是( )
①外围电子构型为nsnnpn的原子形成的化合物的种类最多
②在硫酸铜溶液中加入过量氨水最后生成深蓝色溶液
③H2O是一种非常稳定的化合物,这是由于H2O分子间存在氢键所致
④P4、BF3、CH3Cl三种分子中所有原子的最外层均满足8e-稳定结构
⑤乙醇分子中只含σ键.
①外围电子构型为nsnnpn的原子形成的化合物的种类最多
②在硫酸铜溶液中加入过量氨水最后生成深蓝色溶液
③H2O是一种非常稳定的化合物,这是由于H2O分子间存在氢键所致
④P4、BF3、CH3Cl三种分子中所有原子的最外层均满足8e-稳定结构
⑤乙醇分子中只含σ键.
| A. | ①③⑤ | B. | ③④ | C. | ①②⑤ | D. | ⑤ |
10.以下电子排布式表示基态原子电子排布的是( )
| A. | 1s22s22p63s13p3 | B. | 1s22s22p63s23p63d104s14p1 | ||
| C. | 1s22s22p63s23p63d24s2 | D. | 1s22s22p63s23p63d104s14p2 |
7.C、CO、CH4、C2H5OH是常用的燃料,它们每1g分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为32.8kJ、10.1kJ、55.6kJ、29.7kJ.相同物质的量的这四种燃料,完全燃烧时放出热量最少的是( )
| A. | C | B. | CO | C. | CH4 | D. | C2H5OH |
4.下列有关化学用语正确的是( )
| A. | NH4Cl的电子式: | |
| B. | N2的电子式: | |
| C. | S原子的结构示意图: | |
| D. | 质子数为26、中子数为30的铁原子:${\;}_{26}^{56}$Fe |
5.下列说法正确的是( )
| A. | 可用蘸有浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| B. | 氯水、氨水、浓硝酸都要存放在棕色瓶里 | |
| C. | 铵态氮肥不能与草木灰混合使用,但可以暴晒在太阳底下 | |
| D. | SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
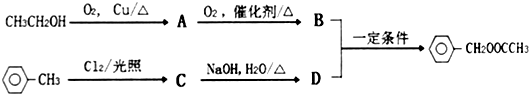
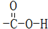 .
.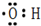 .
.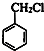 ,D的名称是苯甲醇.
,D的名称是苯甲醇. .
.