题目内容
4. 如图为实验室某浓盐酸试剂瓶标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据(1)该浓盐酸中HCl的物质的量浓度为11.9mol•L-1.
(2)某学生欲用该浓盐酸和蒸馏水配制成1mol•L-1的稀盐酸.现实验室仅需要这种盐酸220mL,试回答下列问题:
①经计算需要21.0mL浓盐酸,在量取时宜选用下列量筒中的C.
A.5mL B.10mL C.25mL D.50mL
②在量取浓盐酸后,进行了下列操作:
a等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中.
b往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.
c在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀.
d用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)cadb.若量取的是浓硫酸,简述第c步实验的操作过程将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌.
③在上述配制过程中,用量筒量取浓盐酸时仰视观察凹液面,其配制的稀盐酸浓度偏高(填“偏高”、“偏低”或“无影响”,下同).若定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线,则配制的稀盐酸浓度偏低.
分析 (1)根据c=$\frac{1000ρω}{M}$计算;
(2)①先计算出浓盐酸的物质的量浓度c=$\frac{1000ρω}{M}$,然后根据溶液稀释前后物质的量不变计算所需浓盐酸的体积;根据“大而近”的原则,根据需要量取的浓盐酸的体积来选择合适的量筒;
②根据实验操作的步骤;c步实验的操作过程将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌,据此进行分析;
③根据c=$\frac{n}{v}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)根据c=$\frac{1000ρω}{M}$可知,密度1.19g/mL、质量分数为36.5%的盐酸物质的量浓度为$\frac{1000×1.19×36.5%}{36.5}$=mol/L=11.9mol/L,
故答案为:11.9;
(2)①浓盐酸的物质的量浓度为c=$\frac{1000×1.19×36.5%}{36.5}$=mol/L=11.9mol/L,设所需浓硫酸的体积为V,则有V×11.9mol/L=0.25L×1mol/L,则V=$\frac{0.25L×1mol/L}{11.9mol/L}$=21.0mL,根据“大而近”的原则,根据需要量取的浓盐酸的体积可知所需的量筒为25mL,
故答案为:21.0;C;
②操作步骤有量取、稀释、移液、洗涤、定容、摇匀等操作;c步实验的操作过程将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌,
故答案为:cadb;将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌;
③用量筒量取浓盐酸时仰视观察凹液面,导致盐酸的体积偏大,即盐酸的物质的量偏大,所以配制溶液的浓度偏高;定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,滞留在刻度线以上的液体过会儿下来,体积偏大,浓度偏低,
故答案为:偏高;偏低.
点评 本题考查了一定物质的量浓度溶液的配制过程、仪器以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是升高温度,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性,则a:b=1:1.
②若所得混合液pH=2,则a:b=9:11.
| A. | 在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可使蛋白质变性,达到消毒的目的 | |
| B. | 使用光导纤维长距离输送电流,可以降低电能损耗 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质 |
| A. | 人们可以利用先进的化学技术和设备制造新的原子 | |
| B. | 人们可以利用催化剂使水变成汽油 | |
| C. | 人们可以利用先进的技术和设备制造新的分子 | |
| D. | 化学科学只能通过实验来探讨物质的性质 |
| A. | MgCl2晶体 | B. | NaCl溶液 | C. | 液态氯化氢 | D. | 熔融的KOH |
| A. | NH3常用作制冷剂 | |
| B. | 小苏打用制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 二氧化硅常用于制造光导纤维 |
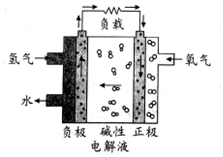
| A. | 通入氢气的电极发生氧化反应 | |
| B. | 正极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 碱性电解液中阳离子向通入氢气的方向移动 | |
| D. | 放电过程中碱性电解液的pH不变 |

 .
.