题目内容
12.(1)过氧化钠的电子式为
(2)工业上利用海水晒盐后的苦卤提镁,一般海里产的贝壳生产沉淀剂,其好处是:就地取材,节约成本.
(3)由14CO和12CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29),则该混合气体中,12CO与14CO密度之比为14:15.
(4)小苏打溶液与过量的石灰水反应的离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O
(5)用双线桥分析Na2O2与CO2反应中电子转移的方向和数目:
 .
.(6)某实验小组利用如图装置(部分固定装置略去)制备氮化钙(Ca3N2),并探究其实验式.

按图连接好实验装置.检查装置的气密性,方法是关闭活塞K,将末端导管插入试管A的水中,用酒精灯微热硬质玻璃管,若导管口有连续均匀的气泡冒出,撤去酒精灯冷却一段时间,导管内形成一段水柱,并且一段时间不回落,说明装置气密性良好.
分析 (1)过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物;
(2)从生产成本分析判断;
(3)根据ρ=$\frac{M}{V{\;}_{m}}$知,其密度之比等于摩尔质量之比;
(4)向NaHCO3溶液中加入过量澄清石灰水,NaHCO3完全反应生成碳酸钙、水、NaOH,据此写出反应的离子方程式;
(5)Na2O2与CO2反应生成了碳酸钠和氧气,化合价升高数=化合价降低数=转移电子数=2;
(6)根据检查装置的气密性的常用方法.
解答 解:(1)过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: ,故答案为:
,故答案为: ;
;
(2)沉淀镁即将其转化成氢氧化镁,则沉淀剂为碱及利用海里产的贝壳煅烧生成氧化钙,再与水反应生成氢氧化钙即可,这样生产就地取材,节约成本,故答案为:就地取材,节约成本;
(3)根据ρ=$\frac{M}{V{\;}_{m}}$知,其密度之比等于摩尔质量之比,12CO与14CO的密度之比=28g/mol:30g/mol=14:15,故答案为:14:15;
(4)氢氧化钙过量,NaHCO3完全反应,反应生成碳酸钙、水、NaOH,反应的离子反应为:HCO3-+Ca2++OH-=CaCO3↓+H2O,
故答案为:HCO3-+Ca2++OH-=CaCO3↓+H2O;
(5)Na2O2与CO2反应生成了碳酸钠和氧气,在Na2O2与CO2的反应中,化合价升高数=化合价降低数=转移电子数=2,电子转移情况为: ,
,
故答案为: ;
;
(6)关闭活塞K,将末端导管插入试管A的水中,用酒精灯微热硬质玻璃管,若导管口有连续均匀的气泡冒出,撤去酒精灯冷却一段时间,导管内形成一段水柱,并且一段时间不回落,说明装置气密性良好,
故答案为:关闭活塞K,将末端导管插入试管A的水中,用酒精灯微热硬质玻璃管,若导管口有连续均匀的气泡冒出,撤去酒精灯冷却一段时间,导管内形成一段水柱,并且一段时间不回落,说明装置气密性良好.
点评 本题考查了电子式的书写,密度的计算,离子方程式的书写以及气密性的检查等化学实验基本操作技能,难度不大,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

| A. | 任何化学反应都能设计成原电池 | |
| B. | 手机上用的锂离子电池属于一次电池 | |
| C. | 原电池中的阳离子向负极移动 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
| A. | 高温下,5.6gFe与足量水蒸气反应,转移的电子数为0.3NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 100g质量分数为17%的H2O2的水溶液中,极性共价键的数目为NA | |
| D. | 室温下向1L pH=1的醋酸溶液中加水稀释,所得溶液中的H+数目大于0.1NA |
| A. | 化石燃料完全燃烧不会造成大气污染 | |
| B. | CaCl2•6H2O可做袋装食品的干燥剂 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 可用Na2CO3治疗胃酸过多 |

 如图为实验室某浓盐酸试剂瓶标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据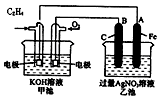 如图是一个化学过程的示意图,请根据该示意图完成下列题目:
如图是一个化学过程的示意图,请根据该示意图完成下列题目: