题目内容
14.2017年2月19日在第十三届阿布扎比国际防务展上,采用先进的氢燃料电池系统的无人机,创造了该级别270分钟续航的新世界记录.下列有关氢燃料电池的说法不正确的是( )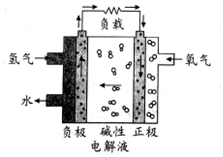
| A. | 通入氢气的电极发生氧化反应 | |
| B. | 正极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 碱性电解液中阳离子向通入氢气的方向移动 | |
| D. | 放电过程中碱性电解液的pH不变 |
分析 氢氧燃料电池工作时,是把化学能转变为电能,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-+2OH-═2H2O,通入氧气的一极为原电池的正极,电极反应式为O2+2H2O+4e-═4OH-,阳离子向正极移动.
解答 解:A、该电池工作时化学能转化为电能,通入氢气的一极为电源的负极,发生氧化反应,故A正确;
B、通入氧气的一极为原电池的正极,电极反应式为O2+2H2O+4e-═4OH-,故B正确;
C、阳离子向正极移动即通入氧气的一极移动,故C错误;
D、由图可知,氢氧燃料电池放电过程中,总反应为氢气和氧气反应生成水从负极边上排除,则碱性电解液的pH不变,故D正确;
故选C.
点评 本题考查氢氧燃料电池的工作原理,题目难度不大,注意正负极的判断及离子流动方向.

练习册系列答案
相关题目
9. 科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示.下列有关说法正确的是( )
科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示.下列有关说法正确的是( )
 科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示.下列有关说法正确的是( )
科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示.下列有关说法正确的是( )| A. | 若 1mol  转化为 1mol 苯酚转移 2mole-,则同时生成的 X 为氯气 转化为 1mol 苯酚转移 2mole-,则同时生成的 X 为氯气 | |
| B. | 用该电池电解饱和食盐水(使用情性电极的电解槽)毎产生 22.4L 的氢气,B 极上生成 0,.5molHCO3- | |
| C. | A 极为正极,B 极为负极 | |
| D. | 电池工作过程中 A 极周围溶液 pH 不断增大 |
19.已知下表为25℃时某些弱酸的电离平衡常数.依据所给信息判断,下列说法正确的是( )
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH)+c(HClO)═c(OH-)-c(H+) | |
| C. | 25℃时,0.10mol•L-1Na2CO3溶液通入CO2至溶液的pH=7时,溶液中:c(Na+)═c(CO32-)+c (HCO3-)+c(H2CO3) | |
| D. | 向0.1mol•L-1CH3COONa溶液中加入少量水,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)•c(O{H}^{-})}$ 增大 |
6.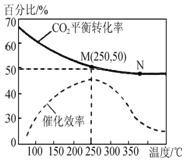 一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
 一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )| A. | 平衡常数:KM>KN | |
| B. | 生成乙烯的速率一定有:v(M)<v(N) | |
| C. | 若投料比n(H2):n(CO2)=3:1,O 达到平衡时,M点乙烯的体积分数约为7.7% | |
| D. | 甲、乙、丙三个相同的恒容密闭容器中均充入0.3molH2和0.1molCO2,加入相同量的催化剂,反应温度T(甲)>T(乙)>T(丙),反应相同时间时,生成乙烯的产量一定为:甲>乙>丙 |
3.化学是一门充满神奇色彩的科学,它与生产生活紧密联系.下列说法正确的是( )
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 金属的硬度都比较大,不能用刀切 | |
| C. | “玉兔”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 煤经过气化和液化等物理变化可转化为清洁燃料 |
15.对于实验I〜IV的描述正确的是( )


| A. | 实验I:逐滴滴加盐酸时,试管中立即产生大量气泡. | |
| B. | 实验II:充分振荡后静置,下层溶液为橙红色,上层无色 | |
| C. | 实验III:从饱和食盐水中提取NaCl晶体 | |
| D. | 装置IV:逐滴加入NaOH溶液时,可以看到白色沉淀,转而变成灰绿色,最后是红褐色 |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据