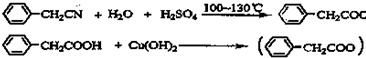题目内容
4.化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:(1)已知:FeO(s)+CO(g)?FeO(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如右表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
②在体积固定的密闭容器中该反应达到平衡状态后,升高温度混合气体的平均相对分子质
量减小(填“增大”、“减小”或“不变”)曰该反应正反应是放热反应(填“吸热”或“放热”).
(2)常温下,下列溶液的浓度均为0.1mol•L-1,测得溶液pH值如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②由表中数据分析,0.01mol•L-1的下列溶液,酸性最弱的是C(填编号).
A、H2CO3 B、HClO C、C6H5OH D、CH3COOH
③向氯水中加入少量的碳酸钠,可以增加氯水中HClO的浓度.为什么?Cl2+H2O?H++Cl-+HClO和2H++CO32-═CO2↑+H2O,少量的Na2CO3可以消耗H+使上述平衡正向移动,增大HClO的浓度.(请结合化学反应简要说明)
分析 (1)①根据反应方程式FeO(s)+CO(g)?Fe(s)+CO2(g)书写K的表达式;
②根据表中数据可知,升高温度,K减小,说明平衡逆移,所以正反应为放热反应;
(2)①对应酸的酸性越弱,其阴离子越易水解,其阴离子结合质子能力越强,反之越弱;
②根据水解程度可判断酸性的强弱;
③氯水中加入少量的碳酸钠溶液,碳酸钠会与溶液中H+反应.
解答 解:(1)①根据反应方程式FeO(s)+CO(g)?Fe(s)+CO2(g)书写K,表达式为K=$\frac{c(C{O}_{2})}{c(CO)}$,
故答案为:$\frac{c(C{O}_{2})}{c(CO)}$;
②根据表中数据可知,升高温度,K减小,说明平衡逆移,所以正反应为放热反应,因此升高温度平均相对分子质量减小,故答案为:减小;放热;
(2)①对应酸的酸性越弱,其阴离子越易水解,其盐溶液碱性越强,所以PH最小的酸性最强,阴离子的水解程度最小,应为CH3COO-,故答案为:CH3COO-;
②水解程度越强,对应的酸的酸性越弱,钠盐的pH越大,酸性最弱的是苯酚,故答案为:C;
③氯水与水反应生成盐酸和次氯酸,发生Cl2+H2O?H++Cl-+HClO,氯水中加入少量的碳酸钠溶液,碳酸钠会与溶液中H+反应,其反应方程为:2H++CO32-=H2O+CO2↑,少量的Na2CO3可以消耗H+使上述平衡正向移动,增大HClO的浓度,
故答案为:Cl2+H2O?H++Cl-+HClO和2H++CO32-═CO2↑+H2O,少量的Na2CO3可以消耗H+使上述平衡正向移动,增大HClO的浓度.
点评 本题考查了平衡常数,盐类水解,溶度积常数的计算,题目综合性较强,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握平衡常数的含有,把握弱电解质的电离特点以及盐类水解的原理,难度不大.

 高中必刷题系列答案
高中必刷题系列答案| A. | 氧化还原反应一定属于四大基本反应类型 | |
| B. | 氧化还原反应中,反应物不是氧化剂就是还原剂 | |
| C. | 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质 | |
| D. | 失电子越多,还原性越强,得电子越多,氧化性越强 |
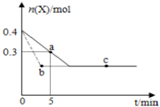 在恒温2L密闭容器中通入气体X并发生反应:2X(g)═Y(g)△H<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )
在恒温2L密闭容器中通入气体X并发生反应:2X(g)═Y(g)△H<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )| A. | 实线表示使用催化剂的情形 | |
| B. | b、c两点表明反应在相应条件下达到了最大限度 | |
| C. | 反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol/(L•min) | |
| D. | 反应进行到a点时放出的热量大于反应进行到b点时放出的热量 |
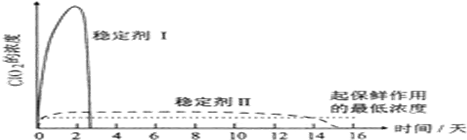
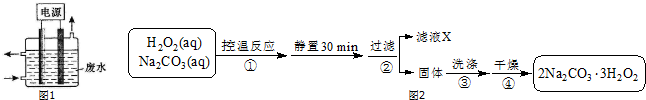
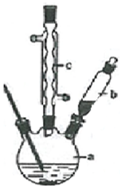 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: