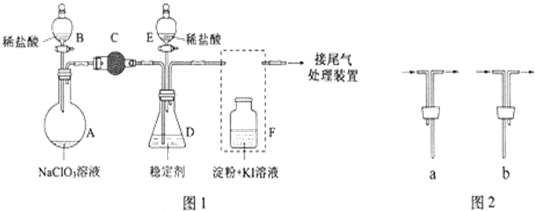
题目内容
3.偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)(1)反应(Ⅰ)中氧化剂是N2O4.
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)?2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为吸热(填“吸热”或“放热”)反应.
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是ad.
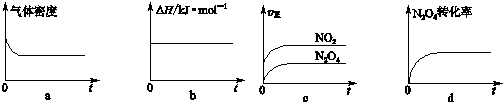
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数不变(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=0.1mol/(L•s).
(4)NO2可用氨水吸收生成两种铵盐.其反应方程式为2NH3•H2O+2NO2═NH4NO3+NH4NO2+H2O.
分析 (1)在氧化还原反应中化合价降低的反应物是氧化剂;
(2)升高温度,平衡向吸热反应方向移动;
(3)根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;
化学平衡常数只与温度有关,与物质的浓度无关;根据v(NO2)=$\frac{△c}{△t}$计算NO2的化学反应速率,再根据同一反应中、同一时间段内反应速率之比等于计量数之比计算v(N2O4);
(4)NO2可用氨水吸收生成两种铵盐,可生成硝酸铵和亚硝酸胺.
解答 解:(1)反应(Ⅰ)中,N2O4(l)中N元素得电子化合价降低,N2O4(l)是氧化剂,(CH3)2NNH2(l)中碳元素化合价升高,是还原剂,
故答案为:N2O4;
(2)升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应即△H>0,
故答案为:吸热;
(3)a.反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b.反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c.根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d.四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变,反应3sNO2的物质的量为0.6mol,v(NO2)=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{1L}}{3s}$=0.2mol/(L•s),则0~3s内的平均反应速率v(N2O4)=0.1mol/(L•s),
故答案为:ad;不变;0.1mol/(L•s);
(4)NO2可用氨水吸收生成两种铵盐,可生成硝酸铵和亚硝酸胺,反应的化学方程式为2NH3•H2O+2NO2═NH4NO3+NH4NO2+H2O,
故答案为:2NH3•H2O+2NO2═NH4NO3+NH4NO2+H2O.
点评 本题考查较为综合,为高频考点,侧重于学生的分析、计算能力的考查,题目涉及氧化还原反应的概念判断,化学平衡的影响因素分析,平衡标志的判断理解,平衡常数的影响因素和计算应用,化学反应速率的计算分析,综合性较大,难度中等.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | 氧化还原反应一定属于四大基本反应类型 | |
| B. | 氧化还原反应中,反应物不是氧化剂就是还原剂 | |
| C. | 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质 | |
| D. | 失电子越多,还原性越强,得电子越多,氧化性越强 |
(1)称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
(2)将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
(3)取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外)碱式滴定管,用酚酞作指示剂时,滴定到溶液颜色由红色刚好变成无色为止;
(4)某同学根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.
②已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.25kJ•mol-1.
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)×(10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)×(10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前3s内的平均反应速率v (N2)=1.42×10-4mol•L-1•s-1.
②在该温度下,反应的平衡常数K=5000.(只写出计算结果)
③该可逆反应△S<0(填“>”、“<”或“=”),在低温(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是B

A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.
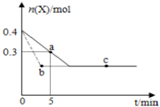 在恒温2L密闭容器中通入气体X并发生反应:2X(g)═Y(g)△H<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )
在恒温2L密闭容器中通入气体X并发生反应:2X(g)═Y(g)△H<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )| A. | 实线表示使用催化剂的情形 | |
| B. | b、c两点表明反应在相应条件下达到了最大限度 | |
| C. | 反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol/(L•min) | |
| D. | 反应进行到a点时放出的热量大于反应进行到b点时放出的热量 |