题目内容
15.已知软锰矿的主要成分是MnO2,闪锌矿的主要成分为ZnS.现用软锰矿、闪锌矿(含有Fe、Cu、Al等元素杂质)联合制备工业产品MnO2和Zn.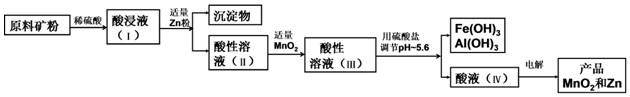
(1)将原料加工成矿粉的目的是增大反应接触面积,加快反应速率
(2)MnO2在酸性条件下能氧化金属硫化物生成硫单质,请写出原料矿粉加稀硫酸后发生的主要化学反应方程式MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O
(3)酸浸液(Ⅰ)中含有的金属阳离子有Mn2+、Fe3+、Zn2+、Cu2+、Al3+
(4)酸浸液(Ⅱ)中加入适量MnO2的作用是将Fe2+氧化成Fe3+;要检验该离子是否完全转化,正确的操作是:取少量待测液于洁净试管中,滴加铁氰化钾溶液,若有特征蓝色沉淀生成,则溶液中含有Fe2+,转化不完全
(5)电解后产品中的MnO2是氧化产物(填“氧化产物”、“还原产物”),若产生的锌为32.5克,则转移电子的数目为NA.
分析 矿粉中加入稀硫酸酸浸,含有的金属阳离子有Mn2+、Fe3+、Zn2+、Cu2+、Al3+等,加入适量锌粉,锌可置换出铜,沉淀物中含有铜等,酸性溶液Ⅱ中加入适量的二氧化锰,可将Fe2+氧化成Fe3+,然后加入碳酸盐调节溶液的pH,可促进铁离子、铝离子的水解,可生成氢氧化铁、氢氧化铝沉淀,溶液Ⅳ中含有Mn2+、Zn2+,电解,可生成MnO2和Zn,
(1)根据固体接触面积大小对反应速率的影响分析;
(2)二氧化锰有较强的氧化性,在酸性溶液中能氧化金属硫化物生成硫单质,据此书写该反应的化学方程式;
(3)由以上分析可判断酸浸液(Ⅰ)中含有的金属阳离子;
(4)MnO2能够将Fe2+氧化成Fe3+;可用铁氰化钾溶液检验亚铁离子;
(5)根据化合价变化判断二氧化锰是氧化产物还是还原产物;计算出锌的物质的量,然后根据电子守恒计算出转移电子的物质的量及数目.
解答 解:矿粉中加入稀硫酸酸浸,含有的金属阳离子有Mn2+、Fe3+、Zn2+、Cu2+、Al3+等,加入适量锌粉,锌可置换出铜,沉淀物中含有铜等,酸性溶液Ⅱ中加入适量的二氧化锰,可将将Fe2+氧化成Fe3+,然后加入碳酸盐调节溶液的pH,可促进铁离子、铝离子的水解,可生成氢氧化铁、氢氧化铝沉淀,溶液Ⅳ中含有Mn2+、Zn2+,电解,可生成MnO2和Zn,
(1)固体接触面积越大反应速率越快,则将原料加工成矿粉的目的是:增大反应接触面积,加快反应速率,
故答案为:增大反应接触面积,加快反应速率;
(2)MnO2有较强的氧化性,在酸性溶液中能氧化金属硫化物生成硫单质,反应的化学方程式为:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,
故答案为:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O;
(3)由以上分析可知矿粉中加入稀硫酸酸浸,含有的金属阳离子有Mn2+、Fe3+、Zn2+、Cu2+、Al3+等,
故答案为:Cu2+;Al3+;
(4)MnO2具有氧化性,酸性溶液(Ⅱ)中加入适量MnO2的作用是将Fe2+氧化成Fe3+;
检验亚铁离子的方法为:取少量待测液于洁净试管中,滴加铁氰化钾溶液,若有特征蓝色沉淀生成,则溶液中含有Fe2+,转化不完全,
故答案为:将Fe2+氧化成Fe3+;取少量待测液于洁净试管中,滴加铁氰化钾溶液,若有特征蓝色沉淀生成,则溶液中含有Fe2+,转化不完全;
(5)Mn2+失去电子被氧化成MnO2,则电解后产品中的MnO2是氧化产物;
32.5gZn的物质的量为:$\frac{32.5g}{65g/mol}$=0.5mol,得到0.5mol金属Zn转移电子的物质的量为:0.5mol×2=1mol,则转移电子的数目为NA,
故答案为:氧化产物;NA.
点评 本题考查制备方案的设计,题目难度中等,涉及化学反应速率影响、化学方程式书写、氧化还原反应及计算、离子检验等知识,根据制备流程明确实验目的为解答关键,注意掌握物质制备方案的设计原则,试题有利于提高学生的分析能力及化学实验能力.

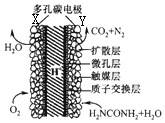 直接尿素电池的结构如图所示,下列说法不正确的是( )
直接尿素电池的结构如图所示,下列说法不正确的是( )| A. | 电池工作时,化学能转化为电能 | |
| B. | 电池工作时,H+向Y极区迁移,Y极周围溶液的pH减小 | |
| C. | 碳电池采用多孔并用触媒层可加快反应速率 | |
| D. | Y极的电极反应式为H2NCONH2+H2O-6e-═N2↑+CO2+6H+ |
2CH4(g)?C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:(Q1、Q2、Q3均为正值)
C(s)+2H2(g)?CH4 (g)△H=-Q1Ⅰ
C(s)+H2(g)═C2H2(g)△H=-Q2Ⅱ
C(s)+H2(g)═$\frac{1}{2}$C2H4(g)△H=-Q3Ⅲ
Q值大小比较正确的是( )
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
| 选项 | 实验操作和现象 | 结论 |
| A | KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色 | 氧化性:Cl2>Br2 |
| B | 室温下,向浓度均为0.1moL•L-1的KCl和KI混合溶液中滴加几滴AgNO3溶液,只出现黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| C | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
| D | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧得到固体残留物 | 该固体为NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Ag+、Cu2+与NH3形成配合物时的配位数 | |
| B. | NaCl的晶格能与MgO的晶格能 | |
| C. | H-F键的极性与H-O键的极性 | |
| D. | BF3的键角CS2的键角 |