题目内容
13.两气体A和B的摩尔质量之比为2:1,则它们在同温、同压、同体积时的分子个数比应为( )| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 4:1 |
分析 同温同压下,气体体积相同则气体的物质的量相同,据此判断.
解答 解:同温同压下,气体体积相同则气体的物质的量相同,气体的物质的量相同则气体分子数相同,即为1:1.
故选A.
点评 本题考查阿伏伽德罗定律及推论,难度不大,关键在于根据气体体积相等推出气体的物质的量相等.注意题目中摩尔质量实际为干扰信息.

练习册系列答案
相关题目
4.下列有关合金性质的说法正确的是( )
(1)合金与各成分金属相比较,具有许多优良的物理,化学或机械性能
(2)相同金属元素形成的合金,元素的含量有可能不同,但其性能是相同的
(3)镁铝合金在盐酸中不能完全溶解
(4)合金具有各成分金属性质之和.
(1)合金与各成分金属相比较,具有许多优良的物理,化学或机械性能
(2)相同金属元素形成的合金,元素的含量有可能不同,但其性能是相同的
(3)镁铝合金在盐酸中不能完全溶解
(4)合金具有各成分金属性质之和.
| A. | (1)(2) | B. | (1)(3) | C. | (1) | D. | (3)(4) |
1.下列有关实验或结论的描述正确的是( )
| A. | 向盐酸酸化的Ba(NO3)2溶液中通入SO2,有白色沉淀生成,则BaSO3难溶于酸 | |
| B. | 液溴应保存在磨口玻璃塞的棕色细口试剂瓶中,并加少量水于液溴上层进行水封 | |
| C. | 向FeI2溶液中加入少量氯水,再加CCl4萃取,CCl4层呈紫红色,Fe2+的还原性强于I- | |
| D. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 |
8.X、Y、Z、M为4种短周期元素,X、Y位于同周期且原子半径r(X)>r(Y),Y2-与M+的电子层结构相同,Z与X的原子核外最外层电子数相同,Z的单质可制成半导体材料.下列说法不正确的是( )
| A. | 由元素X与Z形成的化合物中只含共价键 | |
| B. | XY2、ZY2、M2Y2的晶体分别属于3种不同类型的晶体 | |
| C. | 单质M的晶体是体心立方堆积,M的配位数是8 | |
| D. | X的氢化物X2H2分子中含有2个σ键和3个π键 |
2. 定量分析是化学实验中重要的组成部分.
定量分析是化学实验中重要的组成部分.
Ⅰ.中和热的测定:
(1)在实验室中,用50mL 0.40mol/L的盐酸与50mL 0.50mol/L的NaOH溶液反应测定和热.假设此时溶液密度均为1g/cm3,生成溶液的比容热c=4.18J/(g•℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式
(写出最后结果)△H=-20.9(T2-T1)KJ/mol.
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量.请写出表示该反应中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
Ⅱ.氧化还原滴定实验与中和滴定类似.为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为溶液由无色变为紫色.
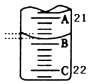
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如表:
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是CD
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C=$\frac{60C}{V}$mol/L.
 定量分析是化学实验中重要的组成部分.
定量分析是化学实验中重要的组成部分.Ⅰ.中和热的测定:
(1)在实验室中,用50mL 0.40mol/L的盐酸与50mL 0.50mol/L的NaOH溶液反应测定和热.假设此时溶液密度均为1g/cm3,生成溶液的比容热c=4.18J/(g•℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式
(写出最后结果)△H=-20.9(T2-T1)KJ/mol.
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量.请写出表示该反应中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
Ⅱ.氧化还原滴定实验与中和滴定类似.为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为溶液由无色变为紫色.
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C=$\frac{60C}{V}$mol/L.
