题目内容
17. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃下,将2mol CO、6mol H2和4molCH3OH充入2L的密闭容器中,判断反应正向(填“正向”或“逆向”)进行.
③要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
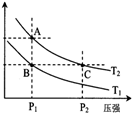
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
分析 (1)①根据化学平衡常数概念k=生成物浓度幂之积:反应物浓度幂之积;分析图象温度升高k减小,向着逆反应方向移动;
②计算300℃下,2mol CO、6mol H2和4molCH3OH充入2L的密闭容器的浓度商Qc,与该温度下的k作比较;
③根据影响化学平衡的因素分析;
(2)增大压强,化学平衡正移动,氢气的体积分数增加;平衡常数与温度有关;该反应为放热反应,升高温度,化学平衡逆向移动,氢气的体积分数增大,结合图象来分析解答;
解答 解:(1)①2H2(g)+CO(g)?CH3OH(g),K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$;分析图象,温度升高后K变小,说明反应逆方向移动,即该反应为放热反应,△H<0;
故答案为:K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$;<;
②由图:300℃下,K=0.270,将2mol CO、6mol H2和4molCH3OH充入2L的密闭容器中,此时反应的浓度商Qc=$\frac{(4mol÷2L)}{(6mol÷2L)^2•(2mol÷2L)}$=$\frac{2}{9}$<K,故反应正向进行;
故答案为:正向;
③要提高CO的转化率,反应正向移动,a.反应为放热反应,升温,逆向移动,错误; b.催化剂不影响平衡,错误; c.增加CO的浓度,平衡正向移动,但CO的转化率减小,错误;d.加入H2加压,正向移动,且CO的 转化率增大,正确;e.加入惰性气体加压,物质的浓度未变,速率不改变,平衡不移动,错误; f.分离出甲醇,生成物浓度减小,反应正向移动,CO的转化率增大,正确;
故答案为:d f;
(2)A、C两点的表示反应在相同温度不同压强下的状态,压强大的反应速率快,所以A点速率小于C点速率;化学平衡常数与温度有关,A、C温度相同,所以平衡常数也相同;A点H2的体积分数比B点高,则要求反应逆向移动,该反应是个放热反应,所以选择升温;
故答案为:<;=;升温.
点评 本题考查化学平衡的图象、,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”原则即可解答,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 漂白粉的有效成分是Ca(ClO)2和CaCl2 | |
| B. | 漂白粉在空气中久置后会变质 | |
| C. | 漂白粉是由Cl2与烧碱制得的 | |
| D. | 在使用漂白粉时应用浓盐酸 |
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有氯化银也有硫化银 | ||
| C. | 只产生黑色硫化银沉淀 | D. | 只有氯化银白色沉淀 |
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | AgCl沉淀多于AgBr沉淀 |
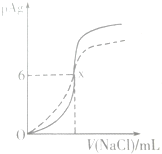 已知pAg=-lg(Ag+),Ksp(AgCl)=1×10-12.如图是向10ml AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知pAg=-lg(Ag+),Ksp(AgCl)=1×10-12.如图是向10ml AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 相同温度下,AgCl在纯水和在NaCl溶液中的溶解度相等 | |
| B. | 原AgNO3溶液的物质的量浓度为0.1mol/L | |
| C. | 图中x的坐标为(100,6) | |
| D. | 0.1mol/L的NaCl溶液换成0.1mol/L的NaI溶液时,图象变为虚线部分 |
| A. | $\frac{{20M×{{10}^{-3}}}}{127}$g | B. | 20M g | C. | $\frac{{20×{{10}^{-3}}}}{M}$g | D. | $\frac{20}{M}$g |
| A. | C | B. | O | C. | P | D. | S |
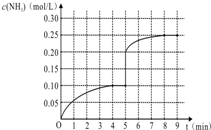 在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: