题目内容
16.键线式可以简明扼要的表示碳氢化合物的结构,键线式为 的物质名称是( )
的物质名称是( )| A. | 丙烯 | B. | 2-丁烯 | C. | 1-丁烯 | D. | 丁烷 |
分析 键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,利用H原子饱和C的四价结构,杂原子及杂原子上的H原子需要标出,据此书写.
解答 解: 键线式中顶端和拐点是碳原子,每个碳原子形成四个共价键,依据所给键线式
键线式中顶端和拐点是碳原子,每个碳原子形成四个共价键,依据所给键线式 得到物质的结构简式为CH3-CH2-CH=CH2;名称依据系统命名方法得到该物质的名称为1-丁烯.
得到物质的结构简式为CH3-CH2-CH=CH2;名称依据系统命名方法得到该物质的名称为1-丁烯.
故选C.
点评 本题考查了有机物质结构、常用化学用语等,难度不大,注意理解键线式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.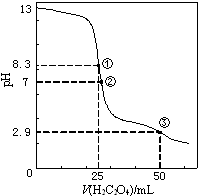 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
7.下列关于酒精的说法,正确的是( )
| A. | 难挥发 | B. | 不能与水互溶 | C. | 能燃烧 | D. | 不能和乙酸反应 |
4.仅由C、H、O三种元素不能构成下列哪类物质( )
| A. | 油脂 | B. | 糖类 | C. | 蛋白质 | D. | 维生素 |
11.“抓好资源节约,建设环境友好型社会”,是我国社会和经济长期发展的重要保证.你认为下列做法与之不相符的是( )
| A. | 推广使用乙醇汽油作汽车燃料 | |
| B. | 研制开发以水代替有机溶剂的化工涂料 | |
| C. | 农村大力发展沼气,将废弃的秸杆转化为清洁高效的能源 | |
| D. | 包装盒、快餐盒等全部用聚苯乙烯生产,以减少木材的使用 |
1.下列有机物名称正确的是( )
| A. | 2-乙基戊烷 | B. | 1,2-二氯丁烷 | ||
| C. | 2,2-二甲基-4-己烯 | D. | 3,4-二甲基辛烷 |
8.对下列实验过程的评价,正确的是( )
| A. | 某溶液中加稀硫酸生成无色气体,说明原溶液中有CO32- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊溶液显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3,有白色沉淀生成,证明含Cl- |
5.短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.Y2+与X3-具有相同的电子层结构,X与Y、Z位于相邻的周期.下列说法正确的是( )
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | Z位于元素周期表的第3周期第ⅥA族 | |
| C. | Y的最高氧化物对应的水化物能溶于NaOH溶液 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
6.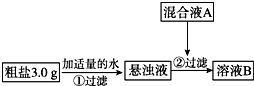 目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
该小组设计流程如图:
(1)加入混合液A的主要成分是NaOH、Na2CO3 (填化学式).
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入NaOH溶液(填化学式),看是否有沉淀生成.
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成.下列三种溶液,其沉淀效果最好的是A.
A.0.1mol•L-1 Na2CO3溶液
B.0.1mol•L-1 Na2SO3溶液
C.0.1mol•L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在1.8×10-7mol•L-1以下.
(4)对溶液B加热并不断滴加6mol•L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C.该操作的目的是除去NaOH和Na2CO3.
(5)溶液C倒入蒸发皿中,加热蒸发并不断搅拌,直到有大量固体析出时停止加热.
(6)足量CaCO3固体分别加入:①30mL水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L氯化钙溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和.
请确定各溶液中Ca2+的浓度由大到小的顺序为:③④①②.
 目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
(1)加入混合液A的主要成分是NaOH、Na2CO3 (填化学式).
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入NaOH溶液(填化学式),看是否有沉淀生成.
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成.下列三种溶液,其沉淀效果最好的是A.
A.0.1mol•L-1 Na2CO3溶液
B.0.1mol•L-1 Na2SO3溶液
C.0.1mol•L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在1.8×10-7mol•L-1以下.
(4)对溶液B加热并不断滴加6mol•L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C.该操作的目的是除去NaOH和Na2CO3.
(5)溶液C倒入蒸发皿中,加热蒸发并不断搅拌,直到有大量固体析出时停止加热.
(6)足量CaCO3固体分别加入:①30mL水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L氯化钙溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和.
请确定各溶液中Ca2+的浓度由大到小的顺序为:③④①②.