题目内容
12.某化学课外小组为了探究AgNO3溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知Ag2SO4在水中微溶,AgCl在水中难溶)| 实验步骤 | 向3-4mL 1mol/L AgNO3溶液中滴入1mol/L的Na2SO4溶液至反应完全. |
| 实验现象 | ①产生白色沉淀 |
| 离子方程式 | 2Ag++SO${\;}_{4}^{2-}$=Ag2SO4 |
| 小组讨论交流 | 取上述反应后的清液于试管中滴入适量1mol/L的NaCl 溶液,对于会出现的现象提出了假设 |
| 提出假设 | 假设Ⅰ:反应没有限度 假设Ⅱ:②无现象 |
| 证明假设Ⅱ | 现象③:产生白色沉淀;理由④反应存在限度,溶液中尚有较多Ag+ |
| 离子方程式 | ⑤Ag++Cl-=AgCl↓ |
| 解释 | ⑥加入Cl-产生了大量的白色沉淀,说明Ag++Cl- AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 |
分析 Ag2SO4在水中微溶,硝酸银溶液中滴入Na2SO4溶液生成沉淀硫酸银,反应后的溶液存在难溶电解质的溶解平衡:Ag++Cl- AgCl↓,加入氯化钠溶液会生成沉淀氯化银,从可逆反应的特征和反应的限度解答本题.
AgCl↓,加入氯化钠溶液会生成沉淀氯化银,从可逆反应的特征和反应的限度解答本题.
解答 解:(1)Ag2SO4在水中微溶,硝酸银溶液中滴入Na2SO4溶液生成沉淀硫酸银,
故答案为:产生白色沉淀;
(2)向上述反应后的清液中滴入适量1mol/L的NaCl溶液,如反应没有限度,Ag+沉淀完全,则无现象,如反应存在限度,溶液中尚有较多Ag+,则应生成白色沉淀AgCl,
故答案为:无现象;产生白色沉淀;反应存在限度,溶液中尚有较多Ag+;
(3)AgCl在水中难溶,反应后的清液中滴入适量1mol/L的NaCl溶液生成白色沉淀AgCl,
反应的离子方程式为Ag++Cl-=AgCl↓,
故答案为:Ag++Cl-=AgCl↓;
(4)AgCl在水中难溶,Ag2SO4在水中微溶,说明AgCl的溶解度较Ag2SO4小,从可逆反应的角度思考,2Ag++SO${\;}_{4}^{2-}$=Ag2SO4↓反应是可逆反应,存在溶解平衡,加入Cl-产生了大量的白色沉淀,属于沉淀的转化问题,
故答案为:加入Cl-产生了大量的白色沉淀,说明Ag++Cl- AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象.
AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象.
点评 本题考查沉淀的转化和可逆反应的特征,注意把握难溶电解质的平衡移动的原理,题目难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
2.由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低.某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:
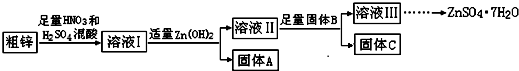
请回答下列问题:
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是将Cu2+(或铜)从溶液Ⅱ中分离出来.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是14.7~14.85g;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=Zn2++H2S↑.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.

| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是将Cu2+(或铜)从溶液Ⅱ中分离出来.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是14.7~14.85g;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=Zn2++H2S↑.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.
3.下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎相同
③元素种类由质子数决定,核素种类由质子数和中子数共同决定,元素主要化学性质 由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎相同
③元素种类由质子数决定,核素种类由质子数和中子数共同决定,元素主要化学性质 由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
| A. | ①②④ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
20.在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol/L和1.5mol/L,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )
| A. | 反应后溶液中H+剩余 1.8mol | |
| B. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 | |
| C. | 反应后产生13.44L H2(标准状况) | |
| D. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol |
7.下列关于酒精的说法,正确的是( )
| A. | 难挥发 | B. | 不能与水互溶 | C. | 能燃烧 | D. | 不能和乙酸反应 |
17.已知Br2、Fe2(SO4)3、CaC2等物质均能与水发生反应,生成两种物质.下表中所列四种物质都易与水反应.
(1)在表中空格处填写各物质分别与水反应的产物中,属于氧化物对应水化物的化学式
(2)写出这四种物质与水反应的产物中,分子构型为正四面体的结构式
(3)由氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺H2NCl,分子结构类似于NH3,H2NCl分子的空间构型为三角锥型,电子式为$\underset{\stackrel{\;}{H:}}{\;}\underset{\stackrel{\underset{H}{••}}{N}}{••}\underset{\stackrel{\;}{:}}{\;}\underset{\stackrel{••}{Cl}}{••}\underset{\stackrel{\;}{:}}{\;}$.
(1)在表中空格处填写各物质分别与水反应的产物中,属于氧化物对应水化物的化学式
| Li3N | NaNH2 | SiBr4 | Mg2Si |

(3)由氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺H2NCl,分子结构类似于NH3,H2NCl分子的空间构型为三角锥型,电子式为$\underset{\stackrel{\;}{H:}}{\;}\underset{\stackrel{\underset{H}{••}}{N}}{••}\underset{\stackrel{\;}{:}}{\;}\underset{\stackrel{••}{Cl}}{••}\underset{\stackrel{\;}{:}}{\;}$.
4.仅由C、H、O三种元素不能构成下列哪类物质( )
| A. | 油脂 | B. | 糖类 | C. | 蛋白质 | D. | 维生素 |
1.下列有机物名称正确的是( )
| A. | 2-乙基戊烷 | B. | 1,2-二氯丁烷 | ||
| C. | 2,2-二甲基-4-己烯 | D. | 3,4-二甲基辛烷 |
2.下列说法正确的是( )
| A. | 纯净物是指由同种元素组成的物质 | B. | 由同种元素组成的纯净物叫单质 | ||
| C. | 由不同种分子组成的物质叫化合物 | D. | 一种元素只能组成一种单质 |