题目内容
 直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.(1)101KPa时,1mol气态CH3OH完全燃烧生成CO2气体和液态水时,放出726.51kJ的热量,则甲醇燃烧的热化学方程式是
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O (g)═CO2(g)+3H2(g);△H1═+49.0KJ?mol-1
②CH3OH(g)+
| 1 |
| 2 |
已知H2(g)+
| 1 |
| 2 |
(3)一种甲醇燃料电池是采用铂或碳化钨作电极,稀硫酸作电解液,一极直接加入纯化后的甲醇,同时向另一个电极通人空气.则甲醇进入
考点:用盖斯定律进行有关反应热的计算,热化学方程式,原电池和电解池的工作原理
专题:
分析:(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,以此书写热化学方程式;
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1、③H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1,①+③得到反应②;
(3)甲醇燃料电池中,甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳;
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1、③H2(g)+
| 1 |
| 2 |
(3)甲醇燃料电池中,甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳;
解答:
解:(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,则燃烧的热化学方程式为CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol;
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1、③H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1,①+③得到反应②,
则△H2=+49.0kJ?mol-1+(-241.8kJ?mol-1)=-192.8kJ?mol-1,故答案为:-192.8kJ?mol-1;
(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,正极电极反应为O2+4H++4e-=2H2O,
故答案为:负;O2+4H++4e-=2H2O.
| 1 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1、③H2(g)+
| 1 |
| 2 |
则△H2=+49.0kJ?mol-1+(-241.8kJ?mol-1)=-192.8kJ?mol-1,故答案为:-192.8kJ?mol-1;
(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,正极电极反应为O2+4H++4e-=2H2O,
故答案为:负;O2+4H++4e-=2H2O.
点评:本题为综合题,涉及反应热的计算、热化学反应方程式的书写、燃料电池等知识点,注重高考常考考点的考查,题目难度中等.

练习册系列答案
相关题目
茶多酚(Tea Polyphenols)是茶叶中多酚类物质的总称.茶多酚中的活性物质没食子儿茶素(EGC)具解毒和抗辐射作用,能有效地阻止放射性物质侵入骨髓,其结构如图所示.关于EGC的下列叙述中正确的是:( )

| A、分子中所有的原子共面 |
| B、1 mol EGC与4 mol NaOH恰好完全反应 |
| C、遇Fe发生显色反应 |
| D、易发生氧化反应和取代反应,相对较难发生加成反应 |
下列比较中,正确的是( )
| A、等温等物质的量浓度溶液中,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol/L NH4Cl溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、同浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O,c(NH4+)由大到小的顺序是①>②>③>④ |
 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A、该反应在T1、T3温度时达到化学平衡 |
| B、该反应在T1温度时达到化学平衡 |
| C、该反应为放热反应 |
| D、升高温度,平衡会向正反应方向移动 |
聚丙烯酸钠(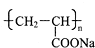 )具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )
)具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )
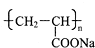 )具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )
)具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )| A、聚丙烯酸钠属于混合物 |
| B、聚丙烯酸钠属于天然有机高分子化合物 |
| C、聚丙烯酸钠可用于生产“尿不湿” |
| D、路面喷洒聚丙烯酸钠溶液能抑制扬尘,一定程度上能预防雾霾和PM2.5 |

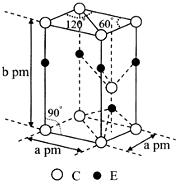 前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.
前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.