题目内容
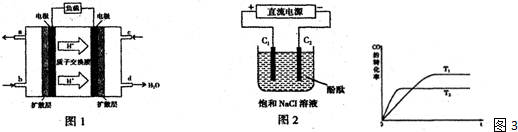
一定条件下,A(g)+B(g)?C(g)△H<0,达到平衡后根据下列图象判断:

(1)升温,达到新平衡的是 (填“A”、“B”、“C”、“D”或“E”,下同),新平衡中C的体积分数 (填“增大”、“减小”或“不变”,下同)
(2)减压,达到新平衡的是 ,A的转化率
(3)减少C的量,达到新平衡的是
(4)增加A的量,达到新平衡的是 ,此时B的转化率 ,A的转化率
(5)使用催化剂,达到新平衡的是 ,C的质量分数 .

(1)升温,达到新平衡的是
(2)减压,达到新平衡的是
(3)减少C的量,达到新平衡的是
(4)增加A的量,达到新平衡的是
(5)使用催化剂,达到新平衡的是
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)升高温度,正逆反应速率加快,化学平衡向着吸热方向进行;
(2)降低压强,化学平衡向着气体系数和增大的方向进行,正逆反应速率减慢;
(3)减小产物的浓度,平衡正向进行;
(4)增加反应物的浓度,平衡正向进行,本身转化率减小,另一种反应物转化率增大;
(5)使用催化剂,会同等程度的加快正逆反应速率,但是平衡不移动.
(2)降低压强,化学平衡向着气体系数和增大的方向进行,正逆反应速率减慢;
(3)减小产物的浓度,平衡正向进行;
(4)增加反应物的浓度,平衡正向进行,本身转化率减小,另一种反应物转化率增大;
(5)使用催化剂,会同等程度的加快正逆反应速率,但是平衡不移动.
解答:
解:(1)升高温度,正逆反应速率瞬间加快,化学平衡向着吸热方向进行,即向着逆反应方向进行,逆反应速率大于正反应速率,产物C的体积分数减小,故答案为:B;减小;
(2)降低压强,化学平衡向着气体系数和增大的方向进行,即向着逆反应方向进行,正逆反应速率减慢,反应物的转化率会减小,故答案为:C;减小;
(3)减小C的量,即减小产物的浓度,平衡正向进行,正逆反应速率均减小,正反应速率大于逆反应速率,速率变化会在原来速率的基础上变化,故答案为:E;
(4)增加A的量,即增大反应物的浓度,平衡正向进行,正反应速率大于逆反应速率,A本身转化率减小,另一种反应物B的转化率增大,故答案为:A;增大;减小;
(5)使用催化剂,会同等程度的加快正逆反应速率,正逆反应速率仍然相等,但是平衡不移动,故答案为:D;不变
(2)降低压强,化学平衡向着气体系数和增大的方向进行,即向着逆反应方向进行,正逆反应速率减慢,反应物的转化率会减小,故答案为:C;减小;
(3)减小C的量,即减小产物的浓度,平衡正向进行,正逆反应速率均减小,正反应速率大于逆反应速率,速率变化会在原来速率的基础上变化,故答案为:E;
(4)增加A的量,即增大反应物的浓度,平衡正向进行,正反应速率大于逆反应速率,A本身转化率减小,另一种反应物B的转化率增大,故答案为:A;增大;减小;
(5)使用催化剂,会同等程度的加快正逆反应速率,正逆反应速率仍然相等,但是平衡不移动,故答案为:D;不变
点评:本题综合考查影响化学反应速率和化学平衡移动的因素:温度、浓度、压强,注意使用催化剂,会同等程度的加快正逆反应速率,但是不会引起平衡的移动,难度不大.

练习册系列答案
相关题目
一定条件下,在体积为3L的密闭容器中,发生反应:CO(g)+2H2(g)?CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示,下列叙述真确的是( )
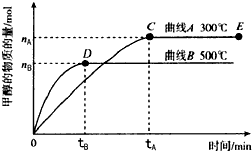

| A、平衡常数K(300℃)小于K(500℃) | ||
| B、在其他条件下不变时,压缩处于E点的体系体积,甲醇浓度增大 | ||
| C、300℃,当容器内气体密度不变时说明反应已经达到平衡 | ||
D、500℃,从反应开始到平衡,氨气的平均反应速率v(H2)=
|
X、Y、Z分别是三种非金属单质,M、N、R是三种常见的氧化物,只有一种氧化物具有高熔点,而且有如下反应(条件未标出,方程未配平):(1)X+Z→N;(2)M+X→N;(3)R+X→Y+N.下列说法正确的是( )
| A、Y是地壳中含量最多的元素 |
| B、非金属性:X>Y |
| C、X、Y同主族,Y、Z同周期 |
| D、高熔点的氧化物是M |
下列图示与对应的叙述相符的是( )
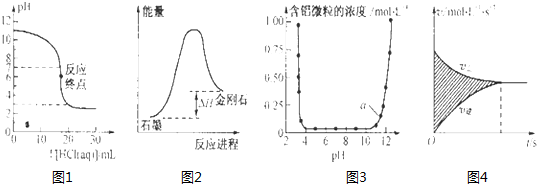

| A、图1表示0.001mol?L-1盐酸滴定0.001mol?L-1NaOH溶液的滴定曲线 |
| B、图2所示,从能量角度考虑,石墨比金刚石稳定 |
| C、图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存Al3+ |
| D、图4所示,图中的阴影部分面积的含义是[v(正)-v (逆)] |

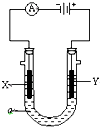 直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.