题目内容
在一定条件下,平衡向正反应方向移动,正反应速率变大. (判断对错)
考点:化学平衡的影响因素
专题:化学反应速率专题
分析:平衡移动的方向决定于正逆反应速率的相对大小,正反应速率增大,平衡不移动正向移动.
解答:
解:给放热反应降温,正逆反应速率都减小,平衡正向移动,故错误,故答案为:错.
点评:本题考查了反应速率的大小与平衡移动的方向没有必然联系,注意平衡移动的方向决定于正逆反应速率的相对大小.

练习册系列答案
相关题目
下列关于电解质的说法正确的是( )
| A、SO2溶于水可以导电,说明SO2是电解质 |
| B、电解质本身可以导电,也可以不导电 |
| C、强电解质与弱电解质的差别就是溶液导电性不同 |
| D、物质的量浓度相同的NaOH溶液与氨水,氨水的pH值较小,说明氨水是弱电解质 |
已知O4是氧元素的一种新的单质,它具有强氧化性,能将Fe2+氧化为Fe3+,其方程式为 O4+Fe2++-Fe3++H2O+O2 (未配平).下列说法正确的是( )
| A、O4和O2是同种物质,都大量存在于空气中 |
| B、该反应需要在酸性条件下进行 |
| C、每生成22.4L O2将转移4NA个电子 |
| D、64gO4和O2的混合气体所含有的分子数为2NA |
如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
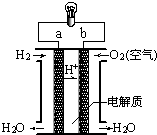

| A、a极是负极 |
| B、正极的电极反应是:O2+2H2O+4e-═4OH- |
| C、电子由a通过灯泡流向b |
| D、氢氧燃料电池是环保电池 |
下列属于吸热反应同时又属于氧化还原反应的是( )
| A、Ca(OH)2与NH4Cl的反应 |
| B、点燃的镁条在二氧化碳中继续燃烧 |
| C、灼热的碳与二氧化碳的反应 |
| D、酸碱中和反应 |
下列两种物质中含有的氧原子数不同的是( )
| A、质量比为2:1的SO2和O2 |
| B、9g水和22gCO2 |
| C、12gNO和9.8gH2SO4 |
| D、物质的量相同的H2SO4和H3PO4 |
标准状况下,两种气体的体积相等,则( )
| A、所含原子数一定相等 |
| B、物质的量一定相等 |
| C、质量一定相等 |
| D、密度一定相等 |
 直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.