题目内容
某化学兴趣小组在实验室进行模拟侯氏制碱法的实验探究如图1,请你参与并协助他们完成相关的实验任务.反应原理为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl ①
2NaHCO3═Na2CO3+CO2↑+H2O↑ ②
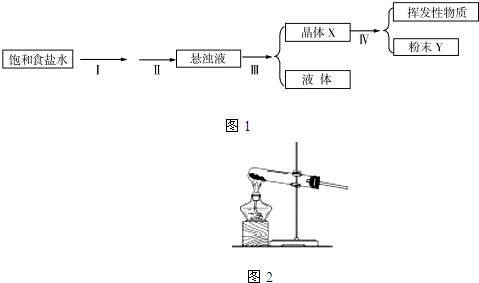
(1)操作Ⅰ、Ⅱ可否颠倒?答: (填“能”或“不能”);操作Ⅲ的名称是 .
(2)写出向晶体X的水溶液中滴加NaOH溶液时发生反应的离子方程式: .
(3)在实验室反应②可在如图2装置中进行,该装置可进行多个化学反应,如实验室制取少量氧气也可利用该装置,请再写出一种利用该装置制取的常见气体的名称.答: .
2NaHCO3═Na2CO3+CO2↑+H2O↑ ②

(1)操作Ⅰ、Ⅱ可否颠倒?答:
(2)写出向晶体X的水溶液中滴加NaOH溶液时发生反应的离子方程式:
(3)在实验室反应②可在如图2装置中进行,该装置可进行多个化学反应,如实验室制取少量氧气也可利用该装置,请再写出一种利用该装置制取的常见气体的名称.答:
考点:纯碱工业(侯氏制碱法)
专题:实验题
分析:(1)根据二氧化碳和氨气的溶解度分析;操作Ⅲ是分离固体和液体,可以用过滤;
(2)根据流程图分析可知,晶体X为碳酸氢钠,与氢氧化钠反应生成碳酸钠;
(3)图2为固体加热装置,适合于用固体加热产生气体的反应;
(2)根据流程图分析可知,晶体X为碳酸氢钠,与氢氧化钠反应生成碳酸钠;
(3)图2为固体加热装置,适合于用固体加热产生气体的反应;
解答:
解:(1)二氧化碳的溶解度较小,中性的氯化钠溶液不易吸收二氧化碳,通入氨气后,溶液呈碱性,增加了二氧化碳的溶解度,利用吸收二氧化碳气体,以便生成碳酸氢钠,操作Ⅲ是分离晶体X和液体的,可以用过滤,
故答案为:不能;过滤;
(2)根据流程图分析可知,晶体X为碳酸氢钠,与氢氧化钠反应生成碳酸钠,离子方程式为OH-+HCO3-═CO32-+H2O,
故答案为:OH-+HCO3-═CO32-+H2O;
(3)图2为固体加热装置,适合于用固体加热产生气体的反应,例如实验室用碱石灰和氯化铵制氨气,
故答案为:实验室用碱石灰和氯化铵制氨气;
故答案为:不能;过滤;
(2)根据流程图分析可知,晶体X为碳酸氢钠,与氢氧化钠反应生成碳酸钠,离子方程式为OH-+HCO3-═CO32-+H2O,
故答案为:OH-+HCO3-═CO32-+H2O;
(3)图2为固体加热装置,适合于用固体加热产生气体的反应,例如实验室用碱石灰和氯化铵制氨气,
故答案为:实验室用碱石灰和氯化铵制氨气;
点评:本题是利用侯氏制碱法的原理考查了实验基本操作和实验原理分析,难度不大,答题时要注意对实验原理的理解与应用.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
配制一定物质的量浓度的溶液时,会导致所配溶液浓度偏大的操作是( )
| A、在用蒸馏水洗涤烧杯时,洗涤液未全部注入容量瓶中 |
| B、定容摇匀后,发现液面低于刻度线,又加水到刻度线 |
| C、定容时俯视刻度线 |
| D、用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 |
下列说法不正确的是( )
| A、通过煤的干馏可获得苯、甲苯等芳香烃 |
| B、在海轮外壳装上锌块,可减缓船体的腐蚀速率 |
| C、电渗析法、离子交换法法中,只有后者可以应用于海水的淡化 |
| D、我国城市推广使用清洁燃料是压缩天然气类和液化石油气类 |
下列属于吸热反应同时又属于氧化还原反应的是( )
| A、Ca(OH)2与NH4Cl的反应 |
| B、点燃的镁条在二氧化碳中继续燃烧 |
| C、灼热的碳与二氧化碳的反应 |
| D、酸碱中和反应 |
 直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.