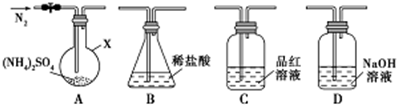
题目内容
7.为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:方案Ⅰ
①称取碳酸钙样品M g
②用c1mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL.
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1g.
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的公式为$\frac{0.1{c}_{1}{V}_{1}-{c}_{2}{V}_{2}}{2M}$×100%.
(2)方案Ⅱ中的“冷却”应如何操作?应该在干燥器中冷却;理由是防止生成的CaO与空气中的CO2、H2O反应,造成误差.
(3)方案Ⅲ中不需要的数据是AB(填选项编号).
A.c、V B.c1、V1 C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是C(填选项编号).
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:称取CaCO3样品Mg,加入过量的盐酸,收集并测定标准状况下生成的气体的体积VmL.
分析 (1)碳酸钙与盐酸反应后剩余盐酸的十分之一被氢氧化钠溶液中和,则与碳酸钙反应的盐酸为C1V1×10-3-10C2V2×10-3,则碳酸钙物质的量为0.5(C1V1×10-3-10C2V2×10-3),据此计算碳酸钙纯度;
(2)因CaO会与空气发生反应,所以放在干燥器中冷却;防止生成的CaO与空气中的CO2、H2O反应,造成误差;
(3)方案Ⅲ是利用固体质量称量来计算碳酸钙的纯度,据此分析判断;
(4)减小误差主要是盐酸溶解后的钙离子全部转移后沉淀出;
(5)实验设计可以利用一定质量的固体中加入过量盐酸充分反应后测定生成二氧化碳气体在标准状况下的气体体积,利用碳元素守恒计算碳酸钙的纯度.
解答 解:(1)碳酸钙与盐酸反应后剩余盐酸的十分之一被氢氧化钠溶液中和,则与碳酸钙反应的盐酸为C1V1×10-3-10C2V2×10-3,则碳酸钙物质的量为0.5(C1V1×10-3-10C2V2×10-3),所以碳酸钙纯度为$\frac{0.1{c}_{1}{V}_{1}-{c}_{2}{V}_{2}}{2M}$×100%,
故答案为:$\frac{0.1{c}_{1}{V}_{1}-{c}_{2}{V}_{2}}{2M}$×100%;
(2)因CaO会与空气中的CO2、H2O发生反应,所以放在干燥器中冷却,防止生成的CaO与空气中的CO2、H2O反应,造成误差;
故答案为:应该在干燥器中冷却;防止生成的CaO与空气中的CO2、H2O反应,造成误差;
(3)加入过量盐酸,碳酸钙全部溶解为氯化钙溶液,加入过量碳酸钠会沉淀钙离子为碳酸钙沉淀,所以最后洗涤干燥得到的沉淀质量即为样品中碳酸钙质量,计算得到质量分数,需要数据是称取碳酸钙样品 M g,将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g,不需要的数据是浓度和体积,
故答案为:AB;
(4)为减少实验误差,必要的操作是,减小误差主要是盐酸溶解后的钙离子全部转移后沉淀出;
A.精确测定Na2CO3溶液体积V′mL,利用的是沉淀质量,碳酸钠溶液过量沉淀钙离子完全即可,故A不符合;
B.精确配制浓度c′mol/L Na2CO3溶液,利用的是沉淀质量,碳酸钠溶液过量沉淀钙离子完全即可,与碳酸钠浓度精确度无关,故B不符合;
C.将步骤③所得沉淀洗涤,洗涤液也应并入④中,保证溶解的钙离子重新全部沉淀出来,故C符合;
故答案为:C;
(5)利用一定质量的固体中加入过量盐酸充分反应后测定生成二氧化碳气体在标准状况下的气体体积,利用碳元素守恒计算碳酸钙的纯度,具体方案为:称取CaCO3样品M g,加入过量的盐酸,收集并测定标准状况下生成的气体的体积VmL,
故答案为:称取CaCO3样品M g,加入过量的盐酸,收集并测定标准状况下生成的气体的体积VmL.
点评 本题考查了探究碳酸钙样品的含量、性质实验方案的设计与评价,题目难度中等,注意掌握实验过程中的数据分析与应用方法,明确评价实验方案的原则.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案| A. | 滴加石蕊试液显红色的溶液:Fe3+、SO42-、C1-、SCN- | |
| B. | c(Al3+)=0.5mol•L的溶液中:Na+、K+、HCO3-、SO42- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10 的溶液中:SO32-、NH4+、NO3-、K+ | |
| D. | 滴加甲基橙试液呈红色的溶液:NH4+、Ba2+、Al3+、Cl- |
| A. | Na2S | B. | Cl2 | C. | CO2 | D. | NaHCO3 |
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式.
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2-→2Al(OH)3↓+Na2CO2+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
| A. | HOCH2CH2COOH | B. | CH3COOH | ||
| C. | HOOC-COOH | D. | 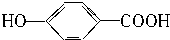 |
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

请回答下列问题:
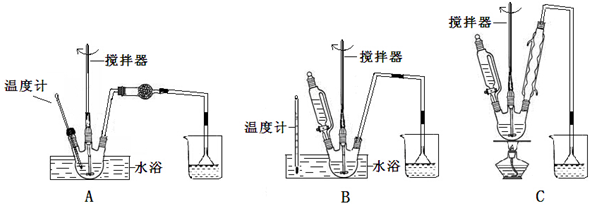
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是B.
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是除去过量的溴水和将葡萄糖酸转化为葡萄糖酸钙;本实验中不宜用CaCl2替代CaCO3,理由是CaCl2不易将葡萄糖酸转化葡萄糖酸钙,也不能除去过量酸性杂质.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是防止温度降低时,葡萄酸钙析出而损失.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.