题目内容
15.钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用.完成下列计算:(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式.
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2-→2Al(OH)3↓+Na2CO2+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
分析 (1)发生反应:2NaN3=2Na+3N2↑,根据方程式计算;
(2)发生反应:2Na+2H2O═2NaOH+H2↑、2K+2H2O═2KOH+H2↑,根据氢气体积、金属质量列方程计算Na、K物质的量;
(3)336L二氧化碳为15mol,只发生反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O,得到30mol Al(OH)3和15molNa2CO3,实际得到24mol Al(OH)3,说明原溶液中含有NaOH,NaOH与二氧化碳反应生成的碳酸钠为15mol-24mol×$\frac{1}{2}$=3mol,即投入112L二氧化碳时与NaOH反应得到碳酸钠也是3mol,再根据方程式2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O计算生成氢氧化铝,根据碳原子守恒可知生成碳酸钠总物质的量;
(4)发生反应:NaOH+HCl=NaCl+H2O,根据方程式计算所取样品的摩尔质量,判断是否含有结晶水确定其组成.
解答 解:(1)设需要NaN3 的质量为m,则:
2NaN3 $\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑
130g 67.2L
m 40.32L
m=$\frac{130g×40.32L}{67.2L}$=78g,
故答案为:78;
(2)设钠、钾的物质的量分别为a、b,
2Na+2H2O═2NaOH+H2↑、2K+2H2O═2KOH+H2↑
a 0.5 b 0.5b
则:0.5a+0.5b=0.075mol,
且23a+39b=5.05(质量守恒)
解之得a=0.050mol,b=0.10mol,
①c(OH-)=$\frac{0.075mol×2}{0.2L}$=0.75mol/L,
故答案为:0.75mol/L;
②n(Na):n(K)=1:2,该钠-钾合金化学式为NaK2,
故答案为:NaK2;
(3)336L二氧化碳为15mol,只发生反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O,得到30mol Al(OH)3和15molNa2CO3,实际得到24mol Al(OH)3,说明原溶液中含有NaOH,NaOH与二氧化碳反应生成的碳酸钠为15mol-24mol×$\frac{1}{2}$=3mol,即投入112L二氧化碳时与NaOH反应得到碳酸钠也是3mol,
112 L二氧化碳的物质的量:$\frac{112L}{22.4L/mol}$=5 mol,根据碳原子守恒则n(Na2CO3)=5mol,由可知[(2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O,生成氢氧化铝为(5-3)mol×2=4mol,
则n[Al(OH)3]:n(Na2CO3)=4mol:5mol=4:5,
故答案为:4:5;
(4)发生反应:NaOH+HCl=NaCl+H2O,
由氯化钠的质量推算,氢氧化钠样品的摩尔质量为
M1(氢氧化钠)=$\frac{58.5}{3.51}$×2.40=40 (g/mol)
M2(氢氧化钠)=$\frac{58.5}{2.34}$×2.32=58 (g/mol)
M3(氢氧化钠)=$\frac{58.5}{3.51}$×3.48=58 (g/mol)
结论:实验①所取氢氧化钠样品是NaOH;
实验②和实验③所取氢氧化钠样品应该是NaOH•H2O,
答:结论为实验①所取氢氧化钠样品是NaOH、实验②和实验③所取氢氧化钠样品应该是NaOH•H2O.
点评 本题考查化学计算,侧重于学生的分析能力和计算能力的考查,是对学生综合能力的考查,题目的难度较大.

| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入烧碱溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定有 NH4+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
 如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )
如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )| A. | 甲、丙 | B. | 乙、丙 | C. | 甲、丁 | D. | 乙、丁 |
| A. | 51.2% | B. | 36.8% | C. | 41.5% | D. | 无法计算 |
 在固态金属氧化物电解池中,高温电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | Y是电源的正极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2ˉ,CO2+2e-═CO+O2- | |
| C. | 总反应可表示为:H2+CO2═H2+CO | |
| D. | 阴、阳两极生成的气体的物质的量之比是2:1 |
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 钠与水的反应Na+2H2O═Na++2OH-+H2↑ |
 .它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
.它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑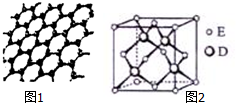 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题: