题目内容
19.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

请回答下列问题:
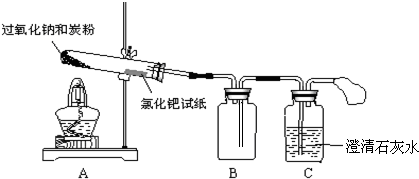
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是B.
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是除去过量的溴水和将葡萄糖酸转化为葡萄糖酸钙;本实验中不宜用CaCl2替代CaCO3,理由是CaCl2不易将葡萄糖酸转化葡萄糖酸钙,也不能除去过量酸性杂质.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是防止温度降低时,葡萄酸钙析出而损失.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
分析 葡萄糖溶液中加入3%溴水、温度控制在55℃,发生的反应为CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr,该反应中生成HBr,为防止污染大气,应该用碱液处理HBr;然后向溶液中加入过量CaCO3、温度控制在70℃,发生反应2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑,葡萄糖酸钙可溶于冷水易溶于热水,所以趁热过滤,将未溶解的碳酸钙除去,然后向滤液中加入乙醇,葡萄糖酸钙微溶于乙醇,所以得到葡萄糖酸钙悬浊液,然后抽滤得到固体,然后洗涤、干燥固体最后得到Ca(C6H11O7)2固体,
(1)由于实验中需要能够控制滴加溴和水浴加热;由于葡萄糖是一种多羟基的醛,所以可以被弱氧化剂氧化成羧酸类,通过醛类催化氧化是最合适的;
(2)增加某一种物质的量,可以提高另一种物质的转化率;根据强酸制备弱酸原理,氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙;
(3)根据表格中葡萄糖酸钙的溶解度与温度的关系解答;
(4)葡萄糖酸钙在乙醇中的溶解度是微溶,有利于葡萄糖酸钙的析出;
(5)利用水可以将无机杂质溶解除掉,同时利用葡萄糖酸钙在乙醇中的微溶,减少葡萄糖酸钙的损失.
解答 解:(1)由于实验中需要能够控制滴加溴和水浴加热,A不能控制添加溴,C没有进行水浴加热,故装置B最合适,由于葡萄糖是一种多羟基的醛,所以可以被弱氧化剂氧化成羧酸类,酸性高锰酸钾溶液可以氧化羟基,A、D会产生重金属杂质离子,通过醛类催化氧化是最合适的,
故答案为:B;C;
(2)第②步充分反应后CaCO3固体需有剩余,其目的是:除去过量的溴水和将葡萄糖酸转化为葡萄糖酸钙,根据强酸制备弱酸原理,CaCl2不易将葡萄糖酸转化葡萄糖酸钙,也不能除去过量酸性杂质,
故答案为:除去过量的溴水和将葡萄糖酸转化为葡萄糖酸钙; CaCl2不易将葡萄糖酸转化葡萄糖酸钙,也不能除去过量酸性杂质;
(3)葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会损失产品,
故答案为:防止温度降低时,葡萄酸钙析出而损失;
(4)葡萄糖酸钙在乙醇中的溶解度是微溶,可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙的析出,
故答案为:可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙的析出;
(5)利用水可以将无机杂质溶解除掉,同时利用葡萄糖酸钙在乙醇中的微溶,减少葡萄糖酸钙的损失,
故选:D.
点评 本题考查物质制备,涉及对工艺流程的理解、对装置于操作的分析与评价、物质的量分离提纯等,操作考查学生对知识的迁移应用,题目体现化学再生活、生产中应用,难度中等.

 在固态金属氧化物电解池中,高温电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | Y是电源的正极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2ˉ,CO2+2e-═CO+O2- | |
| C. | 总反应可表示为:H2+CO2═H2+CO | |
| D. | 阴、阳两极生成的气体的物质的量之比是2:1 |
| A. | Na2S和HCl | B. | Na2S和H2SO4 | C. | Na2SO3和HCl | D. | Na2SO3和H2SO4 |
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 钠与水的反应Na+2H2O═Na++2OH-+H2↑ |
| A. | Na+ | B. | OH- | C. | Cl- | D. | S2- |
| A. | 将煤转化成气体燃料可以有效地减少“温室效应”的气体产生 | |
| B. | 加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用 | |
| C. | 研制开发以水代替有机溶剂的化工涂料 | |
| D. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 |