题目内容
应用化学反应需要研究化学反应的条件、限度和速率.
(1)已知反应:Br2+2Fe2+═2Br-+2Fe3+,向10mL0.1mol?L-1的FeBr2溶液中通入0.001molCl2,反应后,溶液中除含有Cl-外,还一定有 (填序号).
①含Fe2+,不含Fe3+②含Fe3+,不含Br-③含Fe3+,还含有Br-
(2)773K、固定体积的容器中,反应CO(g)+2H2(g)?CH3OH(g)过程中能量变化如图甲.曲线Ⅱ表示使用催化剂时的能量变化.若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值.
①若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③下列与催化剂有关的说法中,正确的是 (填字母序号).
a.使用催化剂,使反应 CO(g)+2H2(g)?CH3OH(g)△H>-91kJ?mol-1
b.使用催化剂,能够提高反应物转化率
c.使用催化剂,不能改变反应的平衡
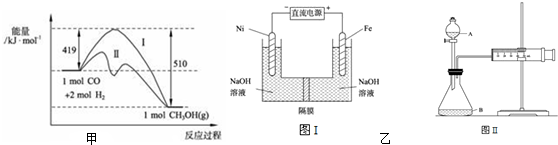
(3)高铁酸盐在能源环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如图乙I所示.
①Ni电极作 极(填“阴”或“阳”);
②Ni电极的电极反应式为: .
(4)氧化还原反应中实际上包含氧化和还原两个过程.下面是HNO3发生的一个还原过程的反应式:
NO3-+4H++3e-→NO↑+2H2O
①KMnO4、HCl、Fe(NO3)2、CuO、KI五种物质中的 (填化学式)能使上述还原过程发生.
②欲用图乙Ⅱ装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其
他影响速率的条件确定之后,可以通过测度 推(计)算反应速率.
(1)已知反应:Br2+2Fe2+═2Br-+2Fe3+,向10mL0.1mol?L-1的FeBr2溶液中通入0.001molCl2,反应后,溶液中除含有Cl-外,还一定有
①含Fe2+,不含Fe3+②含Fe3+,不含Br-③含Fe3+,还含有Br-
(2)773K、固定体积的容器中,反应CO(g)+2H2(g)?CH3OH(g)过程中能量变化如图甲.曲线Ⅱ表示使用催化剂时的能量变化.若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值.
①若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为
②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可)
③下列与催化剂有关的说法中,正确的是
a.使用催化剂,使反应 CO(g)+2H2(g)?CH3OH(g)△H>-91kJ?mol-1
b.使用催化剂,能够提高反应物转化率
c.使用催化剂,不能改变反应的平衡

(3)高铁酸盐在能源环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如图乙I所示.
①Ni电极作
②Ni电极的电极反应式为:
(4)氧化还原反应中实际上包含氧化和还原两个过程.下面是HNO3发生的一个还原过程的反应式:
NO3-+4H++3e-→NO↑+2H2O
①KMnO4、HCl、Fe(NO3)2、CuO、KI五种物质中的
②欲用图乙Ⅱ装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其
他影响速率的条件确定之后,可以通过测度
考点:化学平衡的影响因素,氧化还原反应,化学电源新型电池
专题:
分析:(1)还原性Fe2+>Br-,所以通入0.001molCl2,先氧化亚铁离子,然后再氧化溴离子,由此分析解答;
(2)①转化率=参加反应的CO的物质的量与最初CO的物质的量之比;
②要提高H2的转化率,可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法;
③根据催化剂对可逆反应的影响进行判断;
(3)①铁与电源的正极相连,所以铁是阳极,电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O;
②Ni电极上氢离子放电,电极反应式为:2H2O+2e-═H2↑+2OH-,据此分析解答;
(4)①要使硝酸根离子发生还原反应,则需要加入还原剂;
②根据反应速率的表达式v=
解答.
(2)①转化率=参加反应的CO的物质的量与最初CO的物质的量之比;
②要提高H2的转化率,可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法;
③根据催化剂对可逆反应的影响进行判断;
(3)①铁与电源的正极相连,所以铁是阳极,电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O;
②Ni电极上氢离子放电,电极反应式为:2H2O+2e-═H2↑+2OH-,据此分析解答;
(4)①要使硝酸根离子发生还原反应,则需要加入还原剂;
②根据反应速率的表达式v=
| △v |
| △t |
解答:
解:(1)10mL0.1mol?L-1的FeBr2溶液中溶质的物质的量为:0.001mol,而还原性Fe2+>Br-,所以通入0.001molCl2,0.001molCl2能氧化0.001mol的亚铁离子和0.001mol的溴离子,所还有0.001mol的溴离子未被氧化,故答案为:③;
(2)①若不采取其它方法改变平衡移动时,CO的转化率最小,根据方程式知,参加反应的一氧化碳和生成的甲醇的物质的量相等,所以CO的平衡转化率最小为:
×100%=10%,故答案为:10%;
②可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法来促使平衡向正反应方向移动,从而提高氢气的转化率,
故答案为:增大CO浓度;适当降低温度(或及时分离生成的CH3OH);
③使用催化剂,只能改变反应速率,不能改变化学平衡,则不会改变反应的焓变、不会影响反应物转化率、不影响化学平衡常数,所以ab错误,c正确,
故答案为:c;
(3)①铁与电源的正极相连,所以铁是阳极,发生氧化反应,Ni作阴极,故答案为:阴;
②Ni电极上氢离子放电,电极反应式为:2H2O+2e-═H2↑+2OH-,故答案为:Ni电极上氢离子放电,电极反应式为:2H2O+2e-═H2↑+2OH-;
(4)①要使硝酸根离子发生还原反应,则需要加入还原剂,具有还原性的物质是Fe(NO3)2、KI,故答案为:Fe(NO3)2、KI;
②根据v=
知,可以通过测定单位时间内收集的气体体积(或收集一定体积的气体所用的时间)推(计)算反应速率,
故答案为:单位时间内收集的气体体积(或收集一定体积的气体所用的时间).
(2)①若不采取其它方法改变平衡移动时,CO的转化率最小,根据方程式知,参加反应的一氧化碳和生成的甲醇的物质的量相等,所以CO的平衡转化率最小为:
| 0.1amol |
| amol |
②可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法来促使平衡向正反应方向移动,从而提高氢气的转化率,
故答案为:增大CO浓度;适当降低温度(或及时分离生成的CH3OH);
③使用催化剂,只能改变反应速率,不能改变化学平衡,则不会改变反应的焓变、不会影响反应物转化率、不影响化学平衡常数,所以ab错误,c正确,
故答案为:c;
(3)①铁与电源的正极相连,所以铁是阳极,发生氧化反应,Ni作阴极,故答案为:阴;
②Ni电极上氢离子放电,电极反应式为:2H2O+2e-═H2↑+2OH-,故答案为:Ni电极上氢离子放电,电极反应式为:2H2O+2e-═H2↑+2OH-;
(4)①要使硝酸根离子发生还原反应,则需要加入还原剂,具有还原性的物质是Fe(NO3)2、KI,故答案为:Fe(NO3)2、KI;
②根据v=
| △v |
| △t |
故答案为:单位时间内收集的气体体积(或收集一定体积的气体所用的时间).
点评:本题考查了氧化还原相关知识和化学平衡、化学反应速率及其影响因素、电解原理及其应用,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
25℃某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,在常温下混合后pH=7,则酸溶液体积V酸和碱溶液体积V碱的正确关系为( )
| A、V碱=102V酸 |
| B、V酸=102 V碱 |
| C、V酸=2V碱 |
| D、V碱=2V酸 |
工业上制造金刚砂(SiC)的化学反应如下:SiO2+3C═SiC+2CO↑,在这个反应中,氧化剂和还原剂的物质的量之比是( )
| A、1:2 | B、2:1 |
| C、1:1 | D、3:1 |
氢气在氯气中燃烧产生苍白色火焰,在反应中破坏1mol氢气中的化学键消耗的能量为a KJ,破坏1mol 氯气中的化学键消耗的能量为b KJ,形成1mol氯化氢中的化学键释放的能量为c KJ.下列关系式中正确的是( )
| A、a+b>c |
| B、a+b>2c |
| C、a+b<c |
| D、a+b<2c |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4↓+2H2O,根据此反应判断下列叙述中正确是( )
| A、PbO2是电池的负极 |
| B、负极的电极反应式为:Pb+SO42--2e -=PbSO4↓ |
| C、PbO2得电子,被氧化 |
| D、电池放电时,溶液酸性增强 |
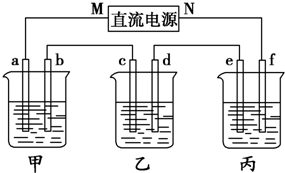 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.