题目内容
工业上制造金刚砂(SiC)的化学反应如下:SiO2+3C═SiC+2CO↑,在这个反应中,氧化剂和还原剂的物质的量之比是( )
| A、1:2 | B、2:1 |
| C、1:1 | D、3:1 |
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:SiO2+3C═SiC+2CO↑中,C元素的化合价降低,C元素的化合价升高,以此来解答.
解答:
解:SiO2+3C═SiC+2CO↑中,C元素的化合价降低,C元素的化合价升高,则C为氧化剂,也为还原剂,由原子和电子守恒可知,1molC得到电子与2molC失去电子数目相等,则氧化剂和还原剂的物质的量之比是1:2,
故选A.
故选A.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应原子和电子守恒的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
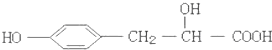 某有机物的结构简式如图,它可能发生的反应类型有:①取代反应;②加成反应;③消去反应;④水解反应;⑤酯化反应;⑥中和反应;⑦氧化反应;⑧加聚反应.( )
某有机物的结构简式如图,它可能发生的反应类型有:①取代反应;②加成反应;③消去反应;④水解反应;⑤酯化反应;⑥中和反应;⑦氧化反应;⑧加聚反应.( )| A、①②③④⑥ |
| B、②③④⑥⑧ |
| C、①②③⑤⑥⑦ |
| D、③⑤⑥⑦⑧ |
将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
| A、K+、SiO32-、Cl-、NO3- |
| B、H+、NH4+、Al3+、SO42- |
| C、Na+、S2-、OH-、SO42- |
| D、Na+、C6H5O-、CH3COO-、HCO3- |
在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离程度增大,H+ 浓度减小,可采用方法是( )
| A、加热 |
| B、加入0.1mol/L 的醋酸溶液100mL |
| C、加入少量的0.5mol/L的硫酸 |
| D、加入少量1mol/L 的NaOH溶液 |
把镁条放入盛有过量盐酸的试管中,不影响氢气产生速率的是( )
| A、盐酸的浓度 |
| B、镁条的表面积 |
| C、加少量Na2SO4固体 |
| D、溶液的温度 |
下列关于胶体的叙述中不正确的是( )
| A、丁达尔现象可用来区别胶体与溶液 |
| B、胶体粒子能通过半透膜,不能通过滤纸 |
| C、胶体不稳定,在一定条件下会发生聚沉 |
| D、溶液、胶体、浊液的根本区别是分散质粒子直径的大小 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、含有 NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、在常温常压下,64g SO2中含有的原子数为3NA |
| C、25℃,1.01×105Pa,11.2L Cl2含有的分子数为0.5NA |
| D、在标准状况下,11.2L H2O含有的分子数为0.5NA |