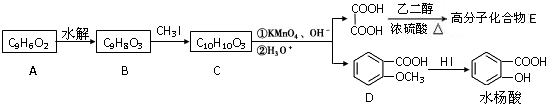
题目内容
实验室制备Cl2的反应原理为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(1)当标准状况下生成11.2L氯气时转移电子的物质的量为 .消耗MnO2质量 克
(2)在此反应中氧化剂是 还原剂是
(3)比较氧化性Cl2 MnO2 (填>、<或=)
| ||
(1)当标准状况下生成11.2L氯气时转移电子的物质的量为
(2)在此反应中氧化剂是
(3)比较氧化性Cl2
考点:氧化还原反应的计算,氧化性、还原性强弱的比较
专题:
分析:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl元素的化合价升高,结合氧化剂的氧化性大于氧化产物的氧化性及利用化合价计算转移电子.
| ||
解答:
解:(1)标准状况下生成11.2L氯气时,氯气的物质的量为
=0.5mol,则转移电子为0.5mol×2×[0-(-1)]=1mol,由反应可知,消耗二氧化锰的物质的量为0.5mol,则消耗MnO2质量为0.5mol×87g/mol=43.5g,
故答案为:3mol;43.5;
(2)Mn元素的化合价降低,Cl元素的化合价升高,则氧化剂为MnO2,还原剂为HCl,故答案为:MnO2;HCl;
(3)氧化剂为MnO2,氧化产物为Cl2,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性为Cl2<MnO2,故答案为:<.
| 11.2L |
| 22.4L/mol |
故答案为:3mol;43.5;
(2)Mn元素的化合价降低,Cl元素的化合价升高,则氧化剂为MnO2,还原剂为HCl,故答案为:MnO2;HCl;
(3)氧化剂为MnO2,氧化产物为Cl2,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性为Cl2<MnO2,故答案为:<.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念及转移电子计算的考查,题目难度不大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、0.1 mol?L-1NH4Cl溶液:c(NH4+)=c(Cl-) |
| B、在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 |
| C、0.1 mol?L-1与0.2 mol?L-1氨水溶液中c(OH-)之比为1:2 |
| D、中和pH与体积都相同的氨水和Ba(OH)2溶液,消耗HCl的物质的量之比是1:2 |
在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离程度增大,H+ 浓度减小,可采用方法是( )
| A、加热 |
| B、加入0.1mol/L 的醋酸溶液100mL |
| C、加入少量的0.5mol/L的硫酸 |
| D、加入少量1mol/L 的NaOH溶液 |
今年我国“天宫一号”空间实验室将与“神舟”载人飞船实现对接.飞船升空所需的巨大能量可由下列化学反应提供:C2H3N2+2N2O4=2CO2+3N2+4H2O.有关该反应的说法正确的是( )
| A、是分解反应 |
| B、是氧化还原反应 |
| C、反应中碳元素的化合价降低 |
| D、氧化剂是C2H3N2 |
锌锰干电池在放电时,电池总反应方程式可表示为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,在电池放电时,正极(碳棒)上发生反应的物质是( )
| A、Zn |
| B、碳棒 |
| C、MnO2和NH4+ |
| D、Zn2+和NH4+ |
下列各组微粒中,互为同位素的是( )
A、
| ||||
| B、H2O和H2O2 | ||||
| C、红磷和白磷 | ||||
| D、甲烷和乙烷 |
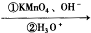 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH