题目内容
14.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )| A. | 质量数为37的氯原子:$\stackrel{17}{37}$Cl | B. | H2O的结构式:H-O-H | ||
| C. | CH4分子的比例模型: | D. | 氯化铵的电子式: |
分析 A.元素符号的左上角为质量数、左下角为质子数;
B.水分子中含有两个碳氢键,用短线代替所有的共用电子对较为结构式;
C.甲烷为正四面体结构, 为球棍模型,比例模型主要体现出各原子的相对体积大小;
为球棍模型,比例模型主要体现出各原子的相对体积大小;
D.氯离子为阴离子,电子式中需要标出最外层电子.
解答 解:A.氯原子的质子数为17,质量数为37的氯原子的表示方法为:1737Cl,故A错误;
B.H2O分子中含有两个O-H键,其结构式为:H-O-H,故B正确;
C.甲烷分子的比例模型应该体现出甲烷分子中各原子的相对体积大小, 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ,故C错误;
,故C错误;
D.NH4Cl为离子化合物,N原子最外层5个电子,Cl原子最外层7个电子,则其电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法判断,题目难度不大,涉及电子式、比例模型与球棍模型、元素符号、结构式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
5.已知Ba(OH)2•8H2O与NH4Cl(s)反应的焓变为△H1,Ba(OH)2•8H2O分解的热焓变为△H2,Ba(OH)2与NH4Cl(s)反应的热焓变△H3<0.则( )
| A. | △H1<0 | B. | △H1>△H2 | C. | △H2═△H1+△H3 | D. | △H2>|△H3| |
2.下列化学方程式正确的是( )
| A. | 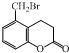 +3NaOH→ +3NaOH→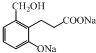 +NaBr+2H2O +NaBr+2H2O | |
| B. |  +Na2CO3→ +Na2CO3→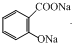 +CO2↑+H2O +CO2↑+H2O | |
| C. | n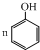 +n +n 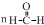 $→_{△}^{催化剂}$ $→_{△}^{催化剂}$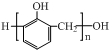 +(n-1)H2O +(n-1)H2O | |
| D. | C12H22O11(麦芽糖)$\stackrel{H+}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖) |
6.如表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是AB(填字母).
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)有机物B具有的性质是②③(填序号).
①无色无味的液体; ②有毒; ③不溶于水; ④密度比水大; ⑤能使酸性KMnO4溶液和溴水褪色
(4)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是:CH3COOH+NaHCO3═CH3COONa+H2O+CO2↑(用化学方程式说明).
| A | ①能使溴的四氯化碳溶液褪色 ②比例模型如图 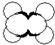 ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成 ②球棍模型如图 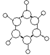 |
| C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是AB(填字母).
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)有机物B具有的性质是②③(填序号).
①无色无味的液体; ②有毒; ③不溶于水; ④密度比水大; ⑤能使酸性KMnO4溶液和溴水褪色
(4)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是:CH3COOH+NaHCO3═CH3COONa+H2O+CO2↑(用化学方程式说明).
3.下列物质的熔、沸点高低顺序中,正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>O2>N2>H2O | D. | 金刚石>生铁>纯铁>钠 |
4.下列粒子(或化学键)的数目之比不是1:1的是( )
| A. | 氘原子(12H)中的质子和中子 | B. | CsCl晶胞中的Cs+和Cl- | ||
| C. | Na2O2固体中的阴离子和阳离子 | D. | CO2分子中的σ键和π键 |

 .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任选).合成路线示例如下CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓H_{2}SO_{4}}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任选).合成路线示例如下CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓H_{2}SO_{4}}^{CH_{3}COOH}$CH3COOCH2CH3.