题目内容
19.100g稀盐酸恰好能跟100g40%的氢氧化钠溶液完全中和,求:(1)生成氯化钠的质量;
(2)稀盐酸中溶质的质量分数.
分析 稀盐酸与氢氧化钠溶液反应生成氯化钠和水,由参加反应的氢氧化钠溶液的质量和溶质的质量分数,计算出生成氯化钠的质量和溶质的质量分数即可.
解答 解:设反应后生成氯化钠的质量为x,盐酸中溶质的质量为y,
HCl+NaOH═NaCl+H2O
36.5 40 58.5
y 100g×40% x
$\frac{36.5}{y}$=$\frac{40}{100g×40%}=\frac{58.5}{x}$
x=58.5g,y=36.5g;
生成氯化钠的质量为58.5g;
稀盐酸中溶质的质量分数为:
$\frac{36.5}{100+100}$×100%=18.25%.
答:(1)生成氯化钠的质量为58.5g;
(2)反应后所得溶液溶质的质量分数为18.25%.
点评 本题难度不大,掌握根据化学方程式与溶质质量分数的综合的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
9.下列化学用语表示正确的是( )
| A. | 甲烷的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 氯化氢的电子式: | D. | S2-的结构示意图: |
7.下列实验操作、实验现象以及实验结论完全正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 植物油中加入含有酚酞的NaOH溶液,微热 | 红色变浅,且不再分层 | 油脂发生了水解反应 |
| B | 柠檬醛( )中加入酸性高锰酸钾溶液 )中加入酸性高锰酸钾溶液 | 溶液褪色 | 柠檬醛分子中含有醛基 |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| D | 向含H2SO4的淀粉水解液中加入新制的Cu(OH)2悬浊液,煮沸 | 没有砖红色沉淀 | 淀粉未水解 |
| A. | A | B. | B | C. | C | D. | D |
14.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 质量数为37的氯原子:$\stackrel{17}{37}$Cl | B. | H2O的结构式:H-O-H | ||
| C. | CH4分子的比例模型: | D. | 氯化铵的电子式: |
4.往NaOH溶液中加入少量的稀醋酸,若温度不变,下列数据一定增大的是( )
| A. | 溶液的导电性 | B. | 水的离子积 | C. | 离子总数 | D. | 溶液pH值 |
11.下列各组离子不能在指定溶液中大量共存的是( )
①加入Al能放出H2的溶液中:NH4+、SO42-、Cl-、HCO3-
②pH=13的溶液中:Na+、AlO2-、NO3-、S2-、SO32-
③水电离出来的c(H+)=10-13 mol/L的溶液:NH4+、K+、NO3-、S2O32-
④AlCl3溶液中:HCO3-、Na+、I-、HS-
⑤能使甲基橙呈黄色的溶液中:K+、SO32-、SO42-、ClO-.
①加入Al能放出H2的溶液中:NH4+、SO42-、Cl-、HCO3-
②pH=13的溶液中:Na+、AlO2-、NO3-、S2-、SO32-
③水电离出来的c(H+)=10-13 mol/L的溶液:NH4+、K+、NO3-、S2O32-
④AlCl3溶液中:HCO3-、Na+、I-、HS-
⑤能使甲基橙呈黄色的溶液中:K+、SO32-、SO42-、ClO-.
| A. | ①②③④ | B. | ①③④⑤ | C. | ②④⑤ | D. | ②③④⑤ |
9.下列说法中正确的是( )
| A. | 石油的分馏和煤的干馏都是物理变化 | |
| B. | 油脂、淀粉、纤维素都是高分子化合物 | |
| C. | 酯类物质是形成水果香味的主要成分 | |
| D. | 纤维素和淀粉互为同分异构体 |
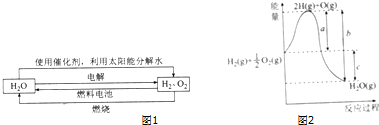 科学家认为氢气是一种高效且无污染的理想能源,近20年来,以氢气为未来的动力燃料的研究获得了迅速发展.
科学家认为氢气是一种高效且无污染的理想能源,近20年来,以氢气为未来的动力燃料的研究获得了迅速发展. ,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.
,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.