题目内容
13. 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫的燃烧的热化学方程式:S(s)+O2(g)═SO2(g)△H=-296.8kJ•mol-1.
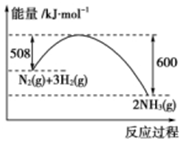
(2)如图是298K、101kPa时,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
分析 (1)16g固体硫为0.5mol,完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kJ热量;
(2)图象分析可知是1molN2与和3molH2完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,据此写出反应的热化学方程式.
解答 解:(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kJ热量,则热化学方程式为:S(s)+O2(g)=SO2(g),△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)═SO2(g)△H=-296.8 kJ•mol-1;
(2)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.
点评 本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,为高频考点,侧重考查学生的分析能力和计算呢利益,题目难度中等,注重基础知识的考查.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
4.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 80g硝酸铵中含有氮原子数为NA | |
| B. | 0.lmolN5+离子中所含的电子数为3.4 NA | |
| C. | 2mol金属铝与足量的盐酸反应,共失去了4NA个电子 | |
| D. | 16 g氧气和16 g臭氧所含的原子数均为0.5NA |
1.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6NA | |
| C. | 25℃时,1L mol•L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
8.下列溶液中c(Cl-)与50mL 1mol•L-1的AlCl3溶液中c(Cl-)相等的是( )
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 CaCl2溶液 | ||
| C. | 150 mL 3 mol•L-1 KCl溶液 | D. | 75 mL 3 mol•L-1 FeCl3溶液 |
18.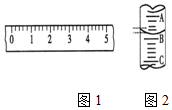 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(2)图2表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是3.2mL.
(3)用18mol•L-1的硫酸溶液配制0.5mol•L-1的硫酸溶液250mL所需的玻璃仪器为10mL量筒,250ml容量瓶,烧杯,玻璃棒,胶头滴管.
 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
(3)用18mol•L-1的硫酸溶液配制0.5mol•L-1的硫酸溶液250mL所需的玻璃仪器为10mL量筒,250ml容量瓶,烧杯,玻璃棒,胶头滴管.
3.下列实验室制取物质的思路既合理又符合绿色化学思想的是( )
| A. | 制取CuSO4:Cu$\stackrel{浓H_{2}SO_{4}、△}{→}$CuSO4 | |
| B. | 制取Cu(NO3)2:Cu$\stackrel{O_{2}、△}{→}$ $\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| C. | 制取Al(OH)3:Al$\stackrel{NaOH}{→}$ $\stackrel{H_{2}SO_{4}}{→}$Al(OH)3 | |
| D. | 制取Na2CO3:Na$\stackrel{O_{2}}{→}$ $\stackrel{CO_{2}}{→}$Na2CO3 |