题目内容
14.设nA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,22.4 L CCl4含有4nA个Cl原子 | |
| B. | 常温常压下,18 g H2O中含有2nA个氢原子 | |
| C. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| D. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 |
分析 A.标准状况下,CCl4的状态不是气体,不能使用标况下的气体摩尔体积计算CCl4的物质的量;
B.18g水的物质的量为1mol,1mol水中含有2mol氢原子;
C.没有告诉氯化钠溶液的体积,无法计算溶液中钠离子数目;
D.过氧化钠与水的反应中,过氧化钠既是氧化剂也是还原剂,0.1mol过氧化钠完全反应转移了0.1mol电子.
解答 解:A.标况下,CCl4不是气体,题中条件无法计算22.4LCCl4的物质的量,故A错误;
B.18g水的物质的量为1mol,含有2mol氢原子,含有2NA个氢原子,故B正确;
C.没有告诉0.1mol•L-1NaCl溶液的体积,无法计算溶液中溶质的物质的量及钠离子数目,故C错误;
D.7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠与水完全反应生成0.05mol氧气,转移了0.1mol电子,转移0.1nA个电子,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,明确标准状况下CCl4不是气体;试题有利于培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.25℃,某溶液中水电离出的c(H+)=10-5mol/L,则该溶液可能是下列情况中的( )
| A. | 该溶液是盐溶液 | |
| B. | 该溶液可能是酸或碱溶 | |
| C. | 该溶液中c(OH-)=10-5mol/L | |
| D. | 该溶液与pH=9的氢氧化钠等体积混合,混合后溶液可能呈中性 |
5.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 盐酸 | B. | 乙醇溶液 | C. | 氯化钠溶液 | D. | Fe(OH)3胶体 |
2.在溶液中能大量共存的离子组是( )
| A. | K+、Fe3+、SCN-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | Na+、Cu2+、Cl-、SO42- |
9.(一)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的两种工艺流程如下:
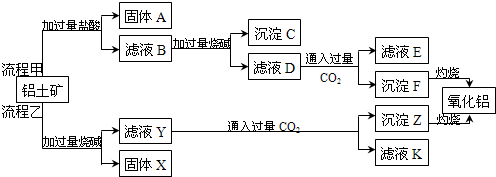
已知:
生成氢氧化物沉淀的pH
请回答下列问题
(1)固体A的主要化学成分是:SiO2(填化学式),
(2)流程乙加入烧碱后生成AlO2-的离子方程式为:Al2O3+2OH-=2AlO2-+H2O
(3)验证滤液B中含有Fe3+的实验操作为:取少量滤液B于试管中,滴加1-2滴硫氰化钾溶液,若溶液变为血红色,则说明滤液B中含有Fe3+
(4)不管是流程甲还是流程乙,都会对铝土矿进行粉碎,原因是:增大固液接触面积,加快反应速率
(5)滤液B也可以通过控制溶液的pH加入氢氧化钠直接得到沉淀F,应调节pH范围为3.2≤pH<3.4.
(二)有机化学
(6)新戊烷的系统命名法命名为:2,3-二甲基丙烷.
(7)按照官能团的分类,有机物 的类别是:酚.
的类别是:酚.
(8)乙酸的核磁共振氢谱图有2个吸收峰,面积比为:1:3或3:1.

已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)固体A的主要化学成分是:SiO2(填化学式),
(2)流程乙加入烧碱后生成AlO2-的离子方程式为:Al2O3+2OH-=2AlO2-+H2O
(3)验证滤液B中含有Fe3+的实验操作为:取少量滤液B于试管中,滴加1-2滴硫氰化钾溶液,若溶液变为血红色,则说明滤液B中含有Fe3+
(4)不管是流程甲还是流程乙,都会对铝土矿进行粉碎,原因是:增大固液接触面积,加快反应速率
(5)滤液B也可以通过控制溶液的pH加入氢氧化钠直接得到沉淀F,应调节pH范围为3.2≤pH<3.4.
(二)有机化学
(6)新戊烷的系统命名法命名为:2,3-二甲基丙烷.
(7)按照官能团的分类,有机物
 的类别是:酚.
的类别是:酚.(8)乙酸的核磁共振氢谱图有2个吸收峰,面积比为:1:3或3:1.
19.化学知识可以帮助理解和解决日常生活中遇到的许多问题,下列说法错误的是( )
| A. | 胃酸过多的病人,可以服用氢氧化钠来中和胃酸 | |
| B. | 晶体硅是在通信工程中制作光导纤维的主要原料 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存 | |
| D. | 二氧化硅与氢氟酸的反应原理可用来雕刻玻璃 |
6.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是( )
| A. | c(H+)<c(OH-) | B. | c(HCN)<c(CN-) | ||
| C. | c(CN-)+c(OH-)=0.1mol?L-1 | D. | c(HCN)+c(CN-)=0.2mol?L-1 |
3.二氧化硫能够使高锰酸钾溶液褪色,表现了二氧化硫的( )
| A. | 酸性 | B. | 氧化性 | C. | 还原性 | D. | 漂白性 |
4.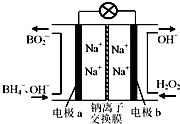 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| B. | 电池放电时Na+从a极区移向b极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |