题目内容
16.写出下列化学方程式,并指出反应类型(1)乙烯与H2O反应CH2=CH2 +H2O$→_{△}^{催化剂}$CH3CH2OH、加成反应
(2)苯的硝化反应C6H6+HNO3$→_{50℃~60℃}^{浓硫酸}$C6H5NO2+H2O、取代反应
(3)乙酸乙酯的制取CH3COOH+C2H5OH
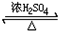 CH3COOC2H5+H2O、酯化反应(取代反应).
CH3COOC2H5+H2O、酯化反应(取代反应).
分析 (1)乙烯含有双键,可以和水发生加成反应生成乙醇;
(2)苯与浓硝酸在浓硫酸作用下,苯环上的氢被硝基取代,反应生成硝基苯和水;
(3)乙酸与乙醇在浓硫酸作用下发生酯化反应,本质为酸脱羟基,醇脱氢,属于取代反应.
解答 解:(1)乙烯含有双键,可以和水发生加成反应生成乙醇,方程式为:CH2=CH2 +H2O$→_{△}^{催化剂}$CH3CH2OH;
故答案为:CH2=CH2 +H2O$→_{△}^{催化剂}$CH3CH2OH、加成反应;
(2)苯和浓硝酸、浓硫酸在50℃~60℃发生硝化反应,苯环上的氢被硝基取代,生成硝基苯和水,该反应为:C6H6+HNO3$→_{50℃~60℃}^{浓硫酸}$C6H5NO2+H2O,
故答案为:C6H6+HNO3$→_{50℃~60℃}^{浓硫酸}$C6H5NO2+H2O、取代反应;
(3)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应(取代反应)生成乙酸乙酯和水,该反应为可逆反应,CH3COOH+C2H5OH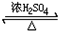 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH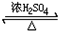 CH3COOC2H5+H2O、酯化反应(取代反应).
CH3COOC2H5+H2O、酯化反应(取代反应).
点评 本题考查化学反应方程式的书写,明确反应的条件及反应产物是解答的关键,并注意反应方程式的配平,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.某原电池结构如图所示,下列有关该原电池的说法正确的是( )
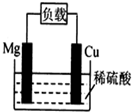

| A. | 电池反应为:Mg+2H+=Mg2++H2↑ | B. | 镁棒发生还原反应 | ||
| C. | 电子从铜棒经外电路流向镁棒 | D. | 铜棒为负极 |
7.室温下,某溶液中由水电离出来的H+和OH-物质的量浓度的乘积为10-24(mol/L)2,下列说法正确的是( )
| A. | HCO3-一定不能大量存在于该溶液中 | |
| B. | NH4+一定不能大量存在于该溶液中 | |
| C. | 该溶液的pH一定为12 | |
| D. | 该溶液中c(H+)=c(OH-) |
4.25℃,某溶液中水电离出的c(H+)=10-5mol/L,则该溶液可能是下列情况中的( )
| A. | 该溶液是盐溶液 | |
| B. | 该溶液可能是酸或碱溶 | |
| C. | 该溶液中c(OH-)=10-5mol/L | |
| D. | 该溶液与pH=9的氢氧化钠等体积混合,混合后溶液可能呈中性 |
11.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 可将地下输油钢管与外加直流电的正极相连以保护它不受腐蚀 | |
| C. | 自然界中钢铁的腐蚀以析氢腐蚀为主 | |
| D. | 生铁在海水中的腐蚀速度比在空气中快 |
5.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 盐酸 | B. | 乙醇溶液 | C. | 氯化钠溶液 | D. | Fe(OH)3胶体 |
6.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是( )
| A. | c(H+)<c(OH-) | B. | c(HCN)<c(CN-) | ||
| C. | c(CN-)+c(OH-)=0.1mol?L-1 | D. | c(HCN)+c(CN-)=0.2mol?L-1 |