题目内容
16. 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.请回答:
Ⅰ.用图 1 所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是A(填字母序号).
(2)N 极发生反应的电极反应式为2H2O+2e-═H2↑+2OH-.
Ⅱ.用图 2 所示装置进行第二组实验.实验过程中,观察到与第一组实验不同的现象:两极 均有气体产生,Y 极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清. 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色.
(3)电解过程中,X 极区溶液的 pH增大(填“增大”“减小”或“不变”).
(4)电解过程中,Y 极发生的电极反应之一为 Fe-6e-+8OH-═Fe4O2-+4H2O 若在 X 极收集到672mL 气体,在 Y 极收集到 168mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁 电极)质量减少0.28g.
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2.该电池正极发生的反应的电极反应式为2FeO42-+6e-+5H2O═Fe2O3+10OH-.
分析 (1)图中,左边装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,如果要找电极材料代替铜,所找材料必须是不如锌活泼的金属或导电的非金属;(2)M是阳极,N是阴极,电解池中阴极上阳离子得电子发生还原反应,原电池放电时,阴离子向负极移动,据此分析;
(3)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液;
(4)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,设铁质量减少为xg,根据转移电子数相等列式解答;
(5)正极上高铁酸根离子得电子发生还原反应生成氧化铁.
解答 解:(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜,
故答案为:A;
(2)N电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-),
故答案为:2H2O+2e-═H2↑+2OH-;
(3)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,溶液的pH增大,故答案为:增大;
(4)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,设铁质量减少为xg,根据转移电子数相等得$\frac{0.672L}{22.4L/mol}$×2=$\frac{0.168L}{22.4L/mol}×4$+$\frac{xg}{56g/mol}×6$,x=0.28,故答案为:0.28;
(5)正极上高铁酸根离子得电子发生还原反应,反应方程式为2FeO42-+6e-+5H2O═Fe2O3+10OH-,故答案为:2FeO42-+6e-+5H2O═Fe2O3+10OH-.
点评 本题考查了原电池和电解池原理,注意:电解池中如果活泼金属作阳极,则电解池工作时阳极材料失电子发生氧化反应,为易错点.

| A. | 4.8mL | B. | 2.4mL | C. | 3mL | D. | 4mL或1.2mL |
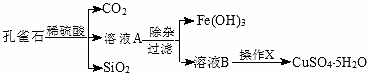
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如表.请回答:
| 物质 | pH (开始沉淀) | pH④ (完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
(2)“除杂”时先加入足量H2O2,目的是将Fe2+氧化成Fe3+;再加入CuO固体调节溶液pH的范围至3.2<pH<4.7,其中加入CuO作用是中和溶液中H+使溶液的pH升高,促进Fe3+水解生成Fe(OH)3沉淀(或调节pH至Fe3+的沉淀范围).
(3)操作X包括蒸发浓缩、冷却结晶、过滤和洗涤等;在进行该操作时,将溶液B再适当酸化目的是抑制Cu2+的水解.
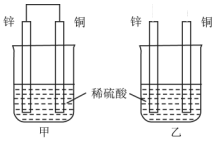 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 甲中电流由锌片经导线流向铜片 | D. | 两烧杯锌片均发生氧化反应 |
| 选项 | 物质(杂质) | 试剂 | 方法 |
| A | CO2(SO2) | 饱和Na2CO3溶液 | 洗气 |
| B | NaCl溶液(Na2CO3) | BaCl2 | 过滤 |
| C | Cl2(HCl) | 饱和NaCl溶液 | 洗气 |
| D | KI溶液(I2) | 乙醇 | 萃取分液 |
| A. | A | B. | B | C. | C | D. | D |