题目内容
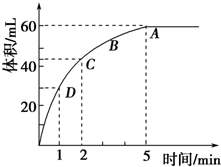 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50mL密度为1.1g?cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50mL密度为1.1g?cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示.请依图回答下列问题:(1)实验时放出气体的总体积为
(2)放出一半气体所需要的时间为
(3)ABCD四点化学反应速率的由快到慢顺序为
(4)以上反应速率的大小变化的原因是
考点:化学反应速率变化曲线及其应用,化学反应速率的影响因素
专题:
分析:反应方程式为:2H2O2
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小.
| ||
解答:
解:(1)由反应方程式为:2H2O2
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,故答案为:60ml;
(2)由图象可知,当时间进行到1min时,需要的时间为1min,故答案为:1 min;
(3)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A;
(4)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小,
故答案为:随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小.
| ||
(2)由图象可知,当时间进行到1min时,需要的时间为1min,故答案为:1 min;
(3)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A;
(4)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小,
故答案为:随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小.
点评:本题考查过氧化氢分解的速率曲线,题目难度不大,主要考查浓度对反应速率的影响,注意对图象的分析.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
13 6 |
13 6 |
| A、核外有13个电子 |
| B、核内有6个质子,核外有7个电子 |
| C、质量数为13,中子数为6 |
| D、质量数为13,质子数为6,核内有7个中子 |
非金属氧化物采用不同的分类方法可分为不同的类别,从某种意义将N2O5、SO3、CO2、Cl2O7等归为一类.则下列氧化物与它们属于同一类的是( )
| A、CO |
| B、NO2 |
| C、SO2 |
| D、NO |
在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A、CH3OH(l)+3
| ||
| B、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452 kJ?mol-1 | ||
| C、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-725.8 kJ?mol-1 | ||
| D、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1452 kJ?mol-1 |

