题目内容
一个原电池总反应式Zn+Cu2+═Zn2++Cu,该电池电极及电解质可能是( )
| 正极 | 负极 | 电解质溶液 | |
| A | Zn | Cu | CuCl2 |
| B | Cu | Zn | H2SO4 |
| C | Cu | Zn | CuSO4 |
| D | Fe | Zn | CuSO4 |
| A、A | B、B | C、C | D、D |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据电池反应式知,失电子的金属作负极,则锌作负极,不如负极活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,所以电解质溶液中含有铜离子,则电解质溶液为可溶性的铜盐.
解答:
解:锌失电子发生氧化反应而作负极,不如锌活泼的金属(Cu、Fe等)或导电的非金属(石墨)作正极,铜离子在正极上得电子发生还原反应,则电解质为可溶性的铜盐,符合条件的是CD.
故选CD.
故选CD.
点评:本题考查了原电池工作原理,判断正负极、电解质溶液时,要根据电池反应式判断:发生氧化反应的电极为负极,发生还原反应的电极为正极,含有发生还原反应的离子溶液为电解质溶液.

练习册系列答案
相关题目
 如图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| A、X是HCl,Y是饱和食盐水 |
| B、X是CO2,Y是稀H2SO4 |
| C、X是SO2,Y是NaOH溶液 |
| D、X是NH3,Y是NaNO3溶液 |
下列叙述中肯定A金属比B金属的活泼性强的是( )
| A、A原子的最外层电子数比B原子的最外层电子数少 |
| B、A的氢氧化物为两性化合物,B的氢氧化物为碱 |
| C、A元素的电负性比B元素的电负性小 |
| D、1摩尔A从酸中置换出H+生成的氢气比1摩尔B从酸中置换的H+生成的氢气多 |
常温下有①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,不正确的是( )
| A、水电离的c(H+):①=②=③=④ |
| B、若将②、③溶液混合后,pH=7,则消耗溶液的体积:②>③ |
| C、等体积的①、②溶液分别与足量铝粉反应,生成H2的量:②比较多 |
| D、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>① |
 如图所示装置进行试验((图中铁架台仪器均已略去),在Ⅰ中加入试剂后,塞紧 橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出,一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上试验现象的Ⅰ和Ⅱ中应加入的试剂是( )
如图所示装置进行试验((图中铁架台仪器均已略去),在Ⅰ中加入试剂后,塞紧 橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出,一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上试验现象的Ⅰ和Ⅱ中应加入的试剂是( )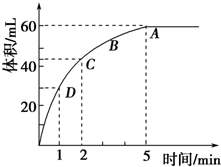 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50mL密度为1.1g?cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50mL密度为1.1g?cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示.请依图回答下列问题: