题目内容
(1)将40gNaOH溶于水,配成250mL溶液甲,甲的 浓度为 mol/L(将正确选项的标号填入空格,下同).将50ml甲加水稀释至100ml后,得溶液乙,乙的浓度为
mol/L.将10ml乙溶液与质量分数为9%、密度为1.11g/cm3的NaOH溶液10ml混合,该混合溶液丙的浓度为 mol/L.(忽略溶液混合时的体积变化).混合溶液丙能与 ml0.5mol/L的盐酸恰好完全中和.
(2)若12.4gNa2X中含有0.4mol钠离子,Na2X的摩尔质量是 ,它的相对分子质量是 .X的相对原子质量是 .
| 选项 | A.4 | B.1 | C.2 | D.90 |
| E.45 | F.35 | G.4.25 | H.2.25 |
考点:物质的量浓度的相关计算,摩尔质量
专题:物质的量浓度和溶解度专题
分析:(1)根据n=
计算NaOH的物质的量,进而根据c=
计算浓度;根据溶液稀释前后溶质的物质的量不变计算稀释后的浓度;根据ρ=
计算NaOH的物质的量浓度,根据二者反应的关系计算反应后的浓度;结合反应的化学方程式计算;
(2)根据化学式及钠离子的物质的量计算出Na2X的物质的量,再根据M=
计算出其摩尔质量;摩尔质量为g/mol时,相对分子质量与摩尔质量的数值相等;根据相对分子质量计算出X的相对原子质量.
| m |
| M |
| n |
| V |
| 1000ρω |
| M |
(2)根据化学式及钠离子的物质的量计算出Na2X的物质的量,再根据M=
| m |
| n |
解答:
解:(1)n(NaOH)=
=1mol,则c(甲)=
=4mol/L,故选A;
溶液稀释前后溶质的物质的量不变,则c(乙)=
=2moL/L,故选C;
质量分数为9%、密度为1.11g/cm3的NaOH溶液的物质的量浓度为c=
≈2.5mol/L,
混合溶液C的浓度c(丙)=
=2.25mol/L,故选H;
C中n(NaOH)=2.25mol/L×0.02L=0.045mol,则可与0.045molHCl完全中和,
所以v(盐酸)=
=0.09L=90mL,故选D,
故答案为:A;C;H;D;
(2)12.4gNa2X中含有0.4mol钠离子,则含有Na2X的物质的量为:0.4mol×
=0.2mol,Na2X的摩尔质量为:
=62g/mol;
Na2X的相对分子量为62,X的相对原子质量为:62-23×2=16,
故答案为:62g/mol;62;16.
| 40g |
| 40g/mol |
| 1mol |
| 0.25L |
溶液稀释前后溶质的物质的量不变,则c(乙)=
| 4mol/L×0.05L |
| 0.1L |
质量分数为9%、密度为1.11g/cm3的NaOH溶液的物质的量浓度为c=
| 1000×1.11g/L×9% |
| 40g/mol |
混合溶液C的浓度c(丙)=
| 2mol/L×0.01L+2.5mol/L×0.01L |
| 0.02L |
C中n(NaOH)=2.25mol/L×0.02L=0.045mol,则可与0.045molHCl完全中和,
所以v(盐酸)=
| 0.045mol |
| 0.5mol/L |
故答案为:A;C;H;D;
(2)12.4gNa2X中含有0.4mol钠离子,则含有Na2X的物质的量为:0.4mol×
| 1 |
| 2 |
| 12.4g |
| 0.2mol |
Na2X的相对分子量为62,X的相对原子质量为:62-23×2=16,
故答案为:62g/mol;62;16.
点评:本题考查了物质的量浓度的计算,题目难度中等,注意掌握物质的量与摩尔质量、物质的量浓度之间的转化关系,明确摩尔质量与相对分子质量最简单关系,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列说法错误的是( )
| A、从1L 1 mol?L-1的氯化钠溶液中取出10ml,其浓度仍是1 mol?L-1 |
| B、100mL 0.2 mol?L-1 BaCl2溶液的与500mL 0.2mol?L-1 NaCl溶液中Cl-的浓度相等 |
| C、0.5 L 2 mol?L-1的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 |
| D、将100mL 0.2 mol?L-1 KNO3溶液加水稀释成200mL配制0.1mol?L-1 KNO3溶液 |
下列关于铝的叙述中,不正确的是( )
| A、铝是地壳里含量最多的金属元素 |
| B、铝容易失去电子,表现还原性 |
| C、在空气中用酒精灯点不着 |
| D、在常温下,铝不能与氧气反应 |
下列叙述中肯定A金属比B金属的活泼性强的是( )
| A、A原子的最外层电子数比B原子的最外层电子数少 |
| B、A的氢氧化物为两性化合物,B的氢氧化物为碱 |
| C、A元素的电负性比B元素的电负性小 |
| D、1摩尔A从酸中置换出H+生成的氢气比1摩尔B从酸中置换的H+生成的氢气多 |
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A、金属性:甲>乙>丁 |
| B、原子半径:辛>戊>甲 |
| C、丙与庚的元素原子核外电子数相差13 |
| D、形成的最简单氢化物的稳定性:己>戊 |
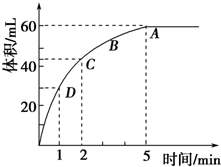 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50mL密度为1.1g?cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50mL密度为1.1g?cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示.请依图回答下列问题: