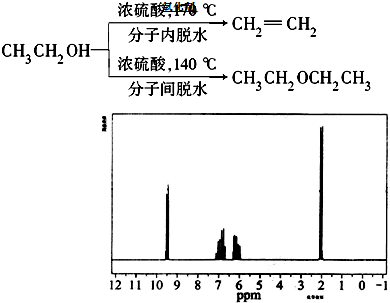
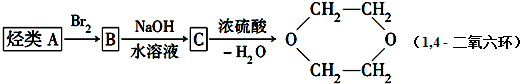
题目内容
在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A、CH3OH(l)+3
| ||
| B、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452 kJ?mol-1 | ||
| C、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-725.8 kJ?mol-1 | ||
| D、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1452 kJ?mol-1 |
考点:热化学方程式
专题:化学反应中的能量变化
分析:在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,则
①32g甲醇即1mol甲醇完全燃烧生成二氧化碳和液态水放出的热量=22.68kJ×32=725.8kJ,其热化学反应方程式为CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
②64g甲醇即2mol甲醇完全燃烧生成二氧化碳和液态水放出的热量=22.68kJ×64=1452kJ,其热化学反应方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452kJ/mol2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452kJ/mol.
①32g甲醇即1mol甲醇完全燃烧生成二氧化碳和液态水放出的热量=22.68kJ×32=725.8kJ,其热化学反应方程式为CH3OH(l)+
| 3 |
| 2 |
②64g甲醇即2mol甲醇完全燃烧生成二氧化碳和液态水放出的热量=22.68kJ×64=1452kJ,其热化学反应方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452kJ/mol2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452kJ/mol.
解答:
解:A、乙醇燃烧属于放热反应,△H<0,故A错误;
B、64g甲醇即2mol甲醇完全燃烧生成二氧化碳和液态水放出的热量=22.68kJ×64=1452kJ,其热化学反应方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452kJ/mol,故B正确;
C、32g甲醇即1mol甲醇完全燃烧生成二氧化碳和液态水放出的热量=22.68kJ×32=725.8kJ,其热化学反应方程式为CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,故C错误;
D、乙醇燃烧属于放热反应,△H<0,故D错误;
故选B.
B、64g甲醇即2mol甲醇完全燃烧生成二氧化碳和液态水放出的热量=22.68kJ×64=1452kJ,其热化学反应方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452kJ/mol,故B正确;
C、32g甲醇即1mol甲醇完全燃烧生成二氧化碳和液态水放出的热量=22.68kJ×32=725.8kJ,其热化学反应方程式为CH3OH(l)+
| 3 |
| 2 |
D、乙醇燃烧属于放热反应,△H<0,故D错误;
故选B.
点评:本题考查热化学反应方程式的书写,注意焓变与反应物的物质的量、物质状态都有关,侧重考查学生计算能力,题目难度不大.

练习册系列答案
相关题目
在相同体积、相同物质的量浓度的溶液中,必然相等的是( )
| A、溶质的物质的量 |
| B、溶质离子的物质的量浓度 |
| C、溶质的质量分数 |
| D、溶质的质量 |
分子式为C10H14,属于苯的同系物,且苯环上的一氯代物只有2种的有机物有(不考虑立体异构,苯环上至少有3个氢)( )
| A、5种 | B、6种 | C、7种 | D、8种 |
下列关于铝的叙述中,不正确的是( )
| A、铝是地壳里含量最多的金属元素 |
| B、铝容易失去电子,表现还原性 |
| C、在空气中用酒精灯点不着 |
| D、在常温下,铝不能与氧气反应 |
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A、金属性:甲>乙>丁 |
| B、原子半径:辛>戊>甲 |
| C、丙与庚的元素原子核外电子数相差13 |
| D、形成的最简单氢化物的稳定性:己>戊 |
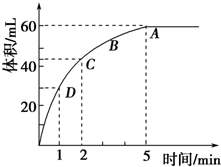 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50mL密度为1.1g?cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50mL密度为1.1g?cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示.请依图回答下列问题: