题目内容
将足量BaCO3分别加入:①30mL水 ②10mL0.2mol/LNa2CO3溶液 ③50mL0.01mol/L氯化钡溶液,请确定各溶液中Ba2+的浓度由大到小的顺序为: .
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:BaCO3溶液存在BaCO3(s)?Ba2+(aq )+CO32-(aq),根据物质中的离子对碳酸钡的溶解是促进还是抑制来分析Ba2+的浓度,以此解答.
解答:
解:①BaCO3加入30mL水中,充分溶解至溶液饱和存在:BaCO3(s)?Ba2+(aq )+CO32-(aq),则溶液中存在一定浓度的Ba2+,但浓度较小;
②将足量BaCO3加入10mL 0.2mol/L Na2CO3溶液中,由于碳酸根离子的浓度较大,抑制碳酸钡的溶解,则Ba2+的浓度较①小;
③将足量BaCO3加入50mL 0.01mol/L氯化钡溶液中,氯化钡电离产生0.01mol/LBa2+,则Ba2+的浓度较大,
各溶液中Ba2+的浓度由大到小的顺序为③>①>②,
故答案为:③>①>②.
②将足量BaCO3加入10mL 0.2mol/L Na2CO3溶液中,由于碳酸根离子的浓度较大,抑制碳酸钡的溶解,则Ba2+的浓度较①小;
③将足量BaCO3加入50mL 0.01mol/L氯化钡溶液中,氯化钡电离产生0.01mol/LBa2+,则Ba2+的浓度较大,
各溶液中Ba2+的浓度由大到小的顺序为③>①>②,
故答案为:③>①>②.
点评:本题考查了溶液中离子浓度大小比较,注意把握难容电解质的溶解平衡的移动,题目难度不大,侧重于平衡移动原理的应用的考查.

练习册系列答案
相关题目
下列实验操作或装置符合实验要求的是( )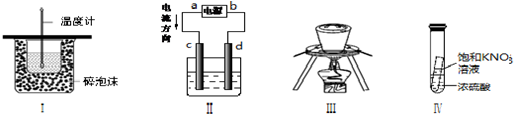

| A、装置Ⅰ可用于测定中和热 |
| B、装置Ⅱ中,c为阳极,d 为阴极 |
| C、装置Ⅲ可用于高温煅烧石灰石 |
| D、实验Ⅳ:静置一段时间,小试管内有晶体析出 |



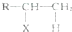 .A、B、C、D、E、M、N有下列转化关系:
.A、B、C、D、E、M、N有下列转化关系: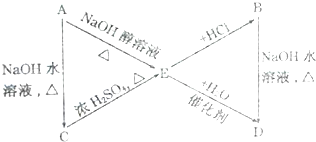
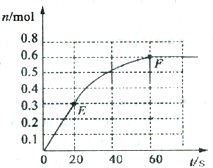 373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.
373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.