题目内容
实验室有一种含有少量二氧化硅杂质的石灰石样品,某同学想准确测定该样品的纯度,某同学想测定该样品的纯度,他取2.0g这种样品置于烧杯中,把20.0g稀盐酸分4次加入,充分反应后记录烧杯中固体质量的变化如下表所示.请选择合适的数据进行计算:
(1)石灰石样品的纯度为 ;
(2)所选用的稀盐酸的物质的量浓度是多少?
| 次序 | 稀盐酸(ml) | 剩余固体(g) |
| 1 | 先加入5.0 | 1.32 |
| 2 | 加入5.0 | 0.64 |
| 3 | 加入5.0 | 0.20 |
| 4 | 加入5.0 | 0.20 |
(2)所选用的稀盐酸的物质的量浓度是多少?
考点:有关混合物反应的计算
专题:计算题
分析:(1)碳酸钙与盐酸反应而溶解,二氧化硅不与盐酸反应,从表中数据知最后剩余的0.20 g为SiO2,进而计算石灰石样品的纯度;
(2)求稀盐酸的物质的量浓度,可借用1、2两组数据,二者的剩余固体质量差(1.32 g-0.64 g)即为跟5.0 mL HCl反应的CaCO3的质量,结合方程式计算.
(2)求稀盐酸的物质的量浓度,可借用1、2两组数据,二者的剩余固体质量差(1.32 g-0.64 g)即为跟5.0 mL HCl反应的CaCO3的质量,结合方程式计算.
解答:
解:(1)从表中数据知最后剩余的0.20 g为SiO2,故样品纯度为
×100%=90%,故答案为:90%;
(2)求稀盐酸的物质的量浓度,可借用1、2两组数据,二者的剩余固体质量差(1.32 g-0.64 g)=0.68g,即为跟5.0 mL HCl反应的CaCO3的质量,
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 g 2 mol
0.68 g n(HCl)
n(HCl)=
×2 mol=1.36×10-2 mol
c(HCl)=
=2.72 mol/L,
答:所选用的稀盐酸的物质的量浓度是2.72mol/L.
| 2.0g-0.20g |
| 2.0g |
(2)求稀盐酸的物质的量浓度,可借用1、2两组数据,二者的剩余固体质量差(1.32 g-0.64 g)=0.68g,即为跟5.0 mL HCl反应的CaCO3的质量,
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 g 2 mol
0.68 g n(HCl)
n(HCl)=
| 0.68g×2mol |
| 100g |
c(HCl)=
| 1.36×10-2mol |
| 5.0×10-3L |
答:所选用的稀盐酸的物质的量浓度是2.72mol/L.
点评:本题考查混合物的有关计算,难度不大,明确发生的反应是解题关键,侧重考查学生分析计算能力.

练习册系列答案
相关题目
某学生的实验报告所列出的下列数据中合理的是( )
| A、用10mL量筒量取8.16mL稀盐酸 |
| B、用托盘天平称取25.20gNaCl |
| C、用广泛pH试纸测得某溶液的pH为2.3 |
| D、用25mL碱式滴定管进行中和滴定时,用去某浓度的碱溶液21.70mL |
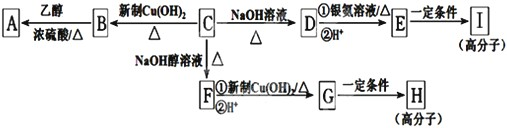
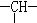 和一个-Cl,它可能的结构有
和一个-Cl,它可能的结构有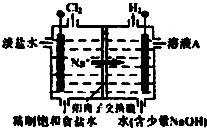 (1)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,该“水”电池在海水中放电时的负极反应式是
(1)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,该“水”电池在海水中放电时的负极反应式是