题目内容
1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体所释放出的热能为氯化钠晶体的晶格能.
(1)下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是 (填字母编号).
A.Na+(g)+Cl-(g)═NaCl(s);△H
B.Na(s)+
Cl2(g)═NaCl(s);△H1
C.Na(s)=Na(g);△H2
D.Na(g)-e-=Na+(g);△H3
E.
Cl2(g)=Cl(g);△H4
F.Cl(g)+e-=Cl-(g);△H5
(2)写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式 .
(1)下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是
A.Na+(g)+Cl-(g)═NaCl(s);△H
B.Na(s)+
| 1 |
| 2 |
C.Na(s)=Na(g);△H2
D.Na(g)-e-=Na+(g);△H3
E.
| 1 |
| 2 |
F.Cl(g)+e-=Cl-(g);△H5
(2)写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式
考点:晶格能的应用,用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化,化学键与晶体结构
分析:(1)依据1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能分析;
(2)依据热化学方程式和盖斯定律计算得到.
(2)依据热化学方程式和盖斯定律计算得到.
解答:
解:(1)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能,则表示出氯化钠晶体晶格能的热化学方程式为:Na-(g)+Cl-(g)═NaCl(s)△H,所以A正确;
故答案为:A;
(2)A.Na-(g)+Cl-(g)═NaCl(s);△H
B.Na-(s)+
Cl2(g)═NaCl(s);△H1
C.Na(s)=Na(g);△H2
D.Na(g)-e-=Na-(g);△H3
E.
Cl2(g)=Cl(g);△H4
F.Cl(g)+e-=Cl(g);△H5
依据盖斯定律A+C+D+E+F得到:Na(s)+
Cl2(g)→NaCl(s)△H1=△H+△H2+△H3+△H4+△H5,
故答案为:△H1=△H+△H2+△H3+△H4+△H5.
故答案为:A;
(2)A.Na-(g)+Cl-(g)═NaCl(s);△H
B.Na-(s)+
| 1 |
| 2 |
C.Na(s)=Na(g);△H2
D.Na(g)-e-=Na-(g);△H3
E.
| 1 |
| 2 |
F.Cl(g)+e-=Cl(g);△H5
依据盖斯定律A+C+D+E+F得到:Na(s)+
| 1 |
| 2 |
故答案为:△H1=△H+△H2+△H3+△H4+△H5.
点评:本题考查了化学反应能量变化,热化学方程式书写和盖斯定律计算应用,注意反应焓变可以依据键能计算,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
将4molA气体和2molB气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol?L-1,下列说法中正确的是( )
| A、当容器内混合气体的密度不再发生变化时,反应即达到平衡状态 |
| B、达平衡后若升高温度,该反应的平衡常数将增大 |
| C、平衡时反应物B的转化率为15.0% |
| D、达平衡后,如果此时移走2 molA和1molB,在相同温度下再达平衡时C的浓度<0.3mol?L-1 |
下列实验操作或记录的数据合理的是( )
| A、在中和反应反应热的测定实验中,用温度计轻轻搅拌混合液充分反应后再读数 |
| B、酸碱中和滴定前滴定管和锥形瓶先用滴定液润洗:2~3次 |
| C、配制硫酸亚铁溶液时,将FeSO4固体溶解在稀硫酸中并加人少量铁,再加水进行有关操作 |
| D、某学生用广泛pH试纸测得某稀盐酸的pH为2.3 |
化学与生产、生活密切相关.下列叙述正确的是( )
| A、二氧化硫的大量排放是造成光化学烟雾的主要原因 |
| B、使用清洁能源是防止酸雨发生的重要措施之一 |
| C、使用无磷洗衣粉,可彻底解决水体富营养化问题 |
| D、某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 |

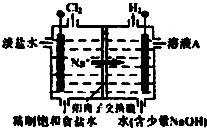 (1)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,该“水”电池在海水中放电时的负极反应式是
(1)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,该“水”电池在海水中放电时的负极反应式是