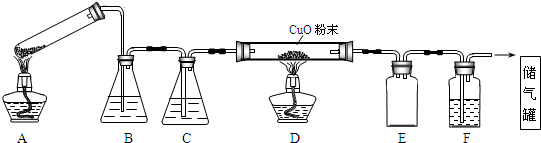
题目内容
17.常温下,下列溶液中的微粒浓度关系正确的是( )| A. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1mol•L-1的Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(CO32-) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) | |
| D. | 常温下,CH3COOH)和CH3COONa混合溶液【PH=7,c(Na+)=0.1mol•L-1】:c(CH3COO-)=0.1mol•L-1 |
分析 A.碳酸氢钠溶液呈碱性,说明碳酸氢根离子的水解程度大于其电离程度,则c(H2CO3)>c(CO32-);
B.根据碳酸钠溶液中的质子守恒判断;
C.溶液中一定满足电荷守恒,根据混合液中的电荷守恒判断;
D.常温下pH=7,溶液呈中性,则c(OH-)=c(H+),结合电荷守恒判断.
解答 解:A.pH=8.3的NaHCO3溶液呈碱性,说明说明HCO3-子的水解程度大于其电离程度,则c(H2CO3)>c(CO32-),正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B.根据0.1mol•L-1的Na2CO3溶液中的质子守恒可知:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故B错误;
C.向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液,根据混合液中的电荷守恒可知:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C错误;
D.常温下,CH3COOH)和CH3COONa混合溶液的pH=7,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒可知c(Na+)=c(CH3COO-)=0.1mol•L-1,故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及质子守恒的含义为解答关键,注意掌握判断离子浓度大小的常用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
7.从柑橘中提取得到结构简式如图所示的化合物,则下列有关它的推断错误的是( )
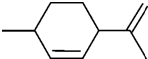

| A. | 属于芳香烃,分子式为C10H16 | B. | 常温下呈液态,比水轻 | ||
| C. | 其一氯代物有8种(不考虑顺反异构) | D. | 能与溴水发生加成反应 |
8.将32g CuO热到900℃,CuO部分分解为Cu2O,最后固体质量为31.2g.则未分解的CuO与分解的CuO的物质的量之比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
5.物质的量浓度相同(0.2mol/L)的弱酸HX与NaX溶液等体积混合后,溶液中微粒浓度关系错误的是( )
| A. | c(Na+)+c(H+)=c(X-)+c(OH-) | |
| B. | c(HX)+c(X-)=c(Na+) | |
| C. | 若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| D. | 若混合液呈酸性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
9.下列叙述正确的是( )
| A. | 含金属元素的离子不一定是阳离子 | |
| B. | 一种元素可形成多种离子,但只能是带同种电荷的离子 | |
| C. | 由同种元素组成的物质肯定属于纯净物 | |
| D. | 具有相同质子数的粒子都属于同种元素 |
6.下列反应:①SO2通入氢硫酸中②SO2通入氯水中③NO2通入水中④Cl2通入溶液中,其中通入的气体只作氧化剂的是( )
| A. | 只有③④ | B. | 只有①② | C. | 只有① | D. | 只有②④ |
7.已知CH3COOH与NH3•H2O的电解质强弱程度相当.室温下,向稀醋酸溶液中加入一定量的某物质后由水电离产生c(H+)=1.0×10-7mol•L-1,则加入的物质可能是( )
| A. | NaCl | B. | NaHSO4 | C. | CH3COONa | D. | CH3COONH4 |
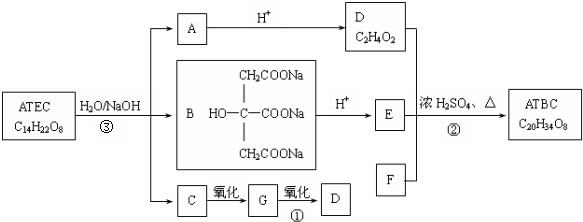
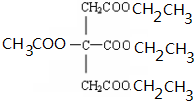 +NaOH$\stackrel{△}{→}$CH3COONa+
+NaOH$\stackrel{△}{→}$CH3COONa+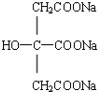 +3CH3CH2OH+3H2O.
+3CH3CH2OH+3H2O.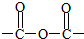 ,E分子在浓硫酸、加热条件下可生成分子甲,其分子式为C6H6O6,则符合上述条件甲分子有2种.
,E分子在浓硫酸、加热条件下可生成分子甲,其分子式为C6H6O6,则符合上述条件甲分子有2种.