题目内容
Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大.W原子最外层电子数与核外电子总数之比为3:4,Q、Y的氧化物是导致酸雨的主要物质,X是地壳中含量最高的金属元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物.
以下问题均有化学用语回答
(1)Q单质的电子式为 .W、X、Y的离子半径由大到小的顺序为 (用离子符号回答)
(2)X和Y组成的化合物放入水中反应的化学方程式是
(3)Na2Y溶液中离子浓度由大到小的顺序为
(4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式
(5)ZCl2溶液中混有FeCl3杂质时,可加入 (填试剂)调节pH= ,再过滤.已知:Fe(OH)3的Ksp=10-35,化学上认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全.
(6)工业上可用高温条件下Z2Y+O2═2Z+YO2来冶炼金属Z,生成1mol Z时转移 mol电子.
以下问题均有化学用语回答
(1)Q单质的电子式为
(2)X和Y组成的化合物放入水中反应的化学方程式是
(3)Na2Y溶液中离子浓度由大到小的顺序为
(4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式
(5)ZCl2溶液中混有FeCl3杂质时,可加入
(6)工业上可用高温条件下Z2Y+O2═2Z+YO2来冶炼金属Z,生成1mol Z时转移
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大,W原子最外层电子数与核外电子总数之比为3:4,故W为氧元素,Q、Y的氧化物是导致酸雨的主要物质,故Q、Y为S或N元素,依据原子序数依次增大,故Q为氮元素,Y为硫元素,X是地壳中含量最高的金属元素,故X是铝元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,故Z是铜元素,据此解答各小题即可.
解答:
解:依据分析可知:Q为N,W为O,X为Al,Y为S,Z为Cu,
(1)Q为氮元素,氮气分子中存在氮氮三键,氮原子最外层为8电子,N2的电子式为: ,元素离子电子层数越多,半径越大,核外电子排布相同的离子,原子序数越小,离子半径越大,故O、Al、S的离子半径由大到小的顺序为:S2->O2->Al3+,故答案为:
,元素离子电子层数越多,半径越大,核外电子排布相同的离子,原子序数越小,离子半径越大,故O、Al、S的离子半径由大到小的顺序为:S2->O2->Al3+,故答案为: ;S2->O2->Al3+;
;S2->O2->Al3+;
(2)Al和S组成的化合物放入水中发生双水解反应,反应的化学方程式是:Al2S3+6H2O=2Al(OH)3↓+3H2S↑,故答案为:Al2S3+6H2O=2Al(OH)3↓+3H2S↑;
(3)Na2S溶液中存在S2-微弱的水解,溶液呈碱性,即:S2-+H2O?HS-+OH-,故溶液中离子浓度由大到小的顺序为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
(4)CuO在高温下与氨气生成氮气,反应的化学方程式为:3CuO+2NH3
3Cu+N2+3H2O,故答案为:3CuO+2NH3
3Cu+N2+3H2O;
(5)Fe(OH)3的Ksp=10-35,化学上认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全,故此时溶液中c(OH-)=
=10-10,故此时c(H+)=
=10-4,故此时pH值为4,当CuCl2溶液中混有FeCl3杂质时,可加入氧化铜调节pH为4,然后再过滤,故答案为:CuO;4;
(6)工业上可用高温条件下Cu2S+O2═2Cu+SO2来冶炼金属Cu,反应中Cu的化合价由+1价变为0价,2molCu元素转移2mol电子,O元素由0价变为-2价,1mol氧气转移4mol电子,故生成2molCu时转移电子数为6mol,生成1molCu转移3mol电子,故答案为3.
(1)Q为氮元素,氮气分子中存在氮氮三键,氮原子最外层为8电子,N2的电子式为:
 ,元素离子电子层数越多,半径越大,核外电子排布相同的离子,原子序数越小,离子半径越大,故O、Al、S的离子半径由大到小的顺序为:S2->O2->Al3+,故答案为:
,元素离子电子层数越多,半径越大,核外电子排布相同的离子,原子序数越小,离子半径越大,故O、Al、S的离子半径由大到小的顺序为:S2->O2->Al3+,故答案为: ;S2->O2->Al3+;
;S2->O2->Al3+;(2)Al和S组成的化合物放入水中发生双水解反应,反应的化学方程式是:Al2S3+6H2O=2Al(OH)3↓+3H2S↑,故答案为:Al2S3+6H2O=2Al(OH)3↓+3H2S↑;
(3)Na2S溶液中存在S2-微弱的水解,溶液呈碱性,即:S2-+H2O?HS-+OH-,故溶液中离子浓度由大到小的顺序为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
(4)CuO在高温下与氨气生成氮气,反应的化学方程式为:3CuO+2NH3
| ||
| ||
(5)Fe(OH)3的Ksp=10-35,化学上认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全,故此时溶液中c(OH-)=
| 3 |
| ||
| 10-14 |
| 10-10 |
(6)工业上可用高温条件下Cu2S+O2═2Cu+SO2来冶炼金属Cu,反应中Cu的化合价由+1价变为0价,2molCu元素转移2mol电子,O元素由0价变为-2价,1mol氧气转移4mol电子,故生成2molCu时转移电子数为6mol,生成1molCu转移3mol电子,故答案为3.
点评:本题是对物质结构的考查,推断元素是解题关键,涉及电子式、离子半径大小比较、离子浓度大小比较、氧化还原反应等,需要学生具备扎实的基础知识,难度中等.

练习册系列答案
相关题目
0.1mol某金属单质与足量的盐酸反应,放出1.12L H2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
| A、第三周期第IA族 |
| B、第四周期第IA族 |
| C、第三周期第ⅡA族 |
| D、第四周期第ⅡA族 |
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和方法不正确的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 碳酸钠溶液 | 分液 |
| D | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A、A | B、B | C、C | D、D |
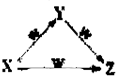 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )①C、CO ②AlCl2、Al(OH)3 ③Fe、Fe(NO3)2 ④NaCO3、NaHCO3.
| A、①②③④ | B、①②④ |
| C、③④ | D、①②③ |
下列溶液中Cl-浓度最小的是( )
| A、400mL1mol/L 盐酸 |
| B、200mL 2.5mol/L MgCl2溶液 |
| C、300mL 2mol/L AlCl3溶液 |
| D、100mL 3mol/L NaCl溶液 |
 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算  我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下: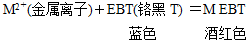
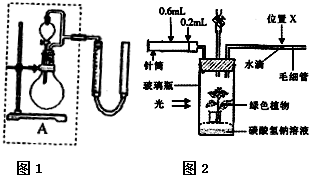 实验1、2研究的目的是
实验1、2研究的目的是