题目内容
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
(1)实验室利用反应2H2O2
2H2O+O2↑可制备氧气.
①取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示.
 实验1、2研究的目的是 对H2O2分解速率的影响.
实验1、2研究的目的是 对H2O2分解速率的影响.
实验2、3的目的是 对H2O2分解速率的影响.
实验中可以表明该反应速率差异的现象是 .
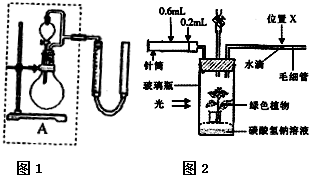
②实验室用MnO2做该反应的催化剂,使用如1图所示装置的A部分制备O2,避免反应过于剧烈的操作是 .
(2)Na2O2与水反应也可生成O2,某同学取4gNa2O2样品与过量水反应,待反应完全终止时,得100mL溶液X和448mLO2(已折算为标准状况),该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究.
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,则反应的离子方程式为 .
②为减小实验误差,量气时应:a:视线平视b:上下移动量气管,使两边液面平齐c:冷却至室温.正确的操作顺序是
③通过如图2所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应,取25mLX,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56mLO2(已折算为标准状况),则此样品中Na2O2的质量分数是 .
(1)实验室利用反应2H2O2
| ||
①取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示.
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | 溶液 | ||
| 2 | 20 | 溶液 | ||
| 3 | 20 | |||
| 4 | 20 | 无 | ||
 实验1、2研究的目的是
实验1、2研究的目的是实验2、3的目的是
实验中可以表明该反应速率差异的现象是
②实验室用MnO2做该反应的催化剂,使用如1图所示装置的A部分制备O2,避免反应过于剧烈的操作是
(2)Na2O2与水反应也可生成O2,某同学取4gNa2O2样品与过量水反应,待反应完全终止时,得100mL溶液X和448mLO2(已折算为标准状况),该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究.
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,则反应的离子方程式为
②为减小实验误差,量气时应:a:视线平视b:上下移动量气管,使两边液面平齐c:冷却至室温.正确的操作顺序是
③通过如图2所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应,取25mLX,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56mLO2(已折算为标准状况),则此样品中Na2O2的质量分数是
考点:探究温度、压强对化学反应速率的影响,性质实验方案的设计
专题:
分析:(1)①通过比较表格中的数据的异同点进行解答;
②根据分液漏斗的结构与功能进行解答;
(2)根据过氧化钠与水反应的方程式以及高锰酸钾与过氧化氢反应,利用物质的量相关公式进行计算.
②根据分液漏斗的结构与功能进行解答;
(2)根据过氧化钠与水反应的方程式以及高锰酸钾与过氧化氢反应,利用物质的量相关公式进行计算.
解答:
解:(1)①影响化学反应速率的外界因素有温度、溶液的浓度和催化剂,通过比较表格中的数据的异同点发现,实验1、2温度不同,实验1为40℃,实验2为20℃,实验2、3的不同点是使用了不同的催化剂,所以比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异性,H2O2分解生成氧气,根据氧气的气泡数可推测反应的速率,故答案为:温度;不同催化剂;产生气泡的快慢;
②过氧化氢在FeCl3溶液催化的作用下分解,反应过于剧烈,可控制滴加的量控制反应的速率,分液漏斗带有玻璃活塞,旋转分液漏斗的活塞,控制滴加H2O2溶液的速率,
故答案为:旋转分液漏斗的活塞,控制滴加H2O2溶液的速率;
(2)①Fe2+能被H2O2氧化为Fe3+在碱性溶液中会生成红褐色沉淀2Fe(OH)3所以反应离子方程式为2Fe2++4OH-+H2O2=2Fe(OH)3↓;
故答案为:2Fe2++4OH-+H2O2=2Fe(OH)3↓;
②因为排出的气体是需要用排出的水的体积衡量的,而反应前后的量筒温度是不同的,因此,反应终止应该先停止加热,待体系恢复到室温时,才取出导管.这一步操作跟通常的实验不同,所以停止加热时导管的出口要高于量筒内的液面,此时即使不取出导管而停止加热,也不会造成水的倒吸;停止加热、回到室温后,将量筒下移以调节量筒内的液面与水槽一致,此时量筒内气体压强也为大气压,读数才是正确的;所以正确的操作顺序为:c使气体都冷却至室温;c调整量筒内外液面高度使之相同;a读取量筒内气体的体积;
故答案为:cba;
③44.8mL O2(已折算为标准状况),为
=0.02mol,同样的计算方法得到56mL O2(已折算为标准状况),为0.0025mol,根据2Na2O2+2H2O═4NaOH+O2↑知与水反应生成氧气的过氧化钠,
2Na2O2 +2H2O═4NaOH+O2↑
0.04mol 0.02mol
滴入烧瓶内再加入过量KMnO4酸性溶液反应,过氧根被氧化成了氧气,根据
5H2O2+2MnO4 -+6H+═2Mn 2++5O2↑+8H2O知与KMnO4酸性溶液反应生成氧气的过氧化钠,
5H2O2+2MnO4 -+6H+═2Mn 2++5O2↑+8H2O
0.0025mol 0.0025mol
某同学取4g Na2O2样品与过量水反应,待反应完全终止时,得100mL溶液X,取25mL X,实验,所以总的过氧化钠为:(0.04+0.0025×4)mol=0.05mol,则此样品中Na2O2的质量分数
×100%=97.5%,
故答案为:97.5%.
②过氧化氢在FeCl3溶液催化的作用下分解,反应过于剧烈,可控制滴加的量控制反应的速率,分液漏斗带有玻璃活塞,旋转分液漏斗的活塞,控制滴加H2O2溶液的速率,
故答案为:旋转分液漏斗的活塞,控制滴加H2O2溶液的速率;
(2)①Fe2+能被H2O2氧化为Fe3+在碱性溶液中会生成红褐色沉淀2Fe(OH)3所以反应离子方程式为2Fe2++4OH-+H2O2=2Fe(OH)3↓;
故答案为:2Fe2++4OH-+H2O2=2Fe(OH)3↓;
②因为排出的气体是需要用排出的水的体积衡量的,而反应前后的量筒温度是不同的,因此,反应终止应该先停止加热,待体系恢复到室温时,才取出导管.这一步操作跟通常的实验不同,所以停止加热时导管的出口要高于量筒内的液面,此时即使不取出导管而停止加热,也不会造成水的倒吸;停止加热、回到室温后,将量筒下移以调节量筒内的液面与水槽一致,此时量筒内气体压强也为大气压,读数才是正确的;所以正确的操作顺序为:c使气体都冷却至室温;c调整量筒内外液面高度使之相同;a读取量筒内气体的体积;
故答案为:cba;
③44.8mL O2(已折算为标准状况),为
| 0.448L |
| 22.4L/mol |
2Na2O2 +2H2O═4NaOH+O2↑
0.04mol 0.02mol
滴入烧瓶内再加入过量KMnO4酸性溶液反应,过氧根被氧化成了氧气,根据
5H2O2+2MnO4 -+6H+═2Mn 2++5O2↑+8H2O知与KMnO4酸性溶液反应生成氧气的过氧化钠,
5H2O2+2MnO4 -+6H+═2Mn 2++5O2↑+8H2O
0.0025mol 0.0025mol
某同学取4g Na2O2样品与过量水反应,待反应完全终止时,得100mL溶液X,取25mL X,实验,所以总的过氧化钠为:(0.04+0.0025×4)mol=0.05mol,则此样品中Na2O2的质量分数
| 0.05mol×78g/mol |
| 4g |
故答案为:97.5%.
点评:本题主要考查了影响化学反应的因素,解答这类题时注意影响化学反应的因素与图表中数据对比的关系,利用相关的化学反应原理进行分析解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
反应4NH3+5O2?4NO+6H2O在一定体积的密闭容器中进行,30s后NO的物质的量浓度增加了3mol/L,则下列反应速率正确的是( )
| A、v (NO)=0.02 mol?(L?s)-1 |
| B、v (NO)=0.2mol?(L?s)-1 |
| C、v (NH3)=0.01 mol?(L?s)-1 |
| D、v (NH3)=0.1 mol?(L?s)-1 |
关于△H的说法不正确的是( )
| A、反应的△H 由生成物与反应物的焓值差决定 |
| B、反应在恒压条件下的热效应为焓变 |
| C、某些反应的△H 可以通过实验测得 |
| D、放热反应的焓变取正值 |
测定稀盐酸和氢氧化钠稀溶液中和热的实 验中没有使用的仪器有:①大、小烧杯;②容量瓶;③量筒;④环形玻璃搅拌棒;⑤试管;⑥温度计;⑦蒸发皿;⑧托盘天平中的( )
| A、②⑤⑦⑧ | B、①②⑥⑦ |
| C、②③⑦⑧ | D、③④⑤⑦ |
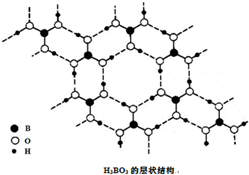 正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )| A、正硼酸晶体中只存在氢键 |
| B、H3BO3分子的稳定性与氢键有关 |
| C、分子中硼原子最外层为8电子稳定结构 |
| D、含1molH3BO3的晶体中有3mol氢键 |
除去下列物质中的杂质(括号内是杂质)所用试剂不正确的是( )
| A、NaOH溶液[Ba(OH)2]:用Na2SO4溶液 |
| B、CuO粉末[Fe粉]:用稀盐酸 |
| C、Mg粉[Al粉]:用NaOH溶液 |
| D、HNO3溶液[HCl]:用AgNO3溶液 |
下列有关金属钠的说法中,错误的是( )
| A、钠只有在加热条件下才能与氯气反应 |
| B、钠与氧气反应的产物与反应条件有关 |
| C、工业上通过电解熔融NaCl制备金属钠 |
| D、实验室常将钠保存在煤油中 |