题目内容
3.【化学-选修5有机化学基础】F、G均是常见的香料,可通过下列途径合成,合成路线如下:
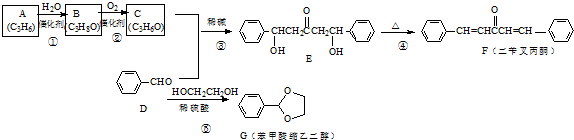
回答下列问题
(1)B的名称为2-丙醇(异丙醇).
(2)③的反应类型是加成反应;④的反应类型是消去反应.
(3)C的结构简式是
 ;A加聚产物的结构简式是
;A加聚产物的结构简式是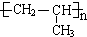 .
.(4)F分子中位于同一平面的碳原子最多有17个.
(5)G的芳香同分异构体中且能发生银镜反应和水解反应的异构体有14种,其中核磁共振氢谱只有四组峰的异构体结构简式为
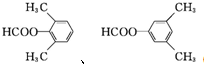 .
.
分析 A和水发生加成反应生成B,其A符合单烯烃通式,则A结构简式为CH3CH=CH2,A与水发生加成反应生成B,B氧化生成C,C与苯甲醛反应生成E,结合E与苯甲醛结构简式可知C为 ,则B为
,则B为 ,E加热发生消去反应生成F,F中碳碳双键断裂,乙二醇中O-H键断裂,发生取代反应生成G,同时还生成丙酮,据此分析解答.
,E加热发生消去反应生成F,F中碳碳双键断裂,乙二醇中O-H键断裂,发生取代反应生成G,同时还生成丙酮,据此分析解答.
解答 解:A和水发生加成反应生成B,其A符合单烯烃通式,则A结构简式为CH3CH=CH2,A与水发生加成反应生成B,B氧化生成C,C与苯甲醛反应生成E,结合E与苯甲醛结构简式可知C为 ,则B为
,则B为 ,E加热发生消去反应生成F,F中碳碳双键断裂,乙二醇中O-H键断裂,发生取代反应生成G,同时还生成丙酮,
,E加热发生消去反应生成F,F中碳碳双键断裂,乙二醇中O-H键断裂,发生取代反应生成G,同时还生成丙酮,
(1)B结构简式为 ,其名称是2-丙醇(异丙醇),故答案为:2-丙醇(异丙醇);
,其名称是2-丙醇(异丙醇),故答案为:2-丙醇(异丙醇);
(2)③的反应类型是加成反应;④的反应类型是消去反应,故答案为:加成反应;消去反应;
(3)C的结构简式为 ,A为CH3CH=CH2,A加聚产物的结构简式是
,A为CH3CH=CH2,A加聚产物的结构简式是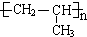 ,故答案为:CH3COCH3;
,故答案为:CH3COCH3;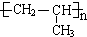 ;
;
(4)苯中所有原子共平面、乙烯中所有原子共平面、丙酮中C、O原子共平面,则F分子中位于同一平面的碳原子最多有17个,故答案为:17;
(5)G的芳香同分异构体中能发生银镜反应和水解反应,含有甲酸形成酯基,含有1个取代基,为-CH2CH2OOCH或者-CH(CH3)OOCH,含有2个取代基,为-CH3、-CH2OOCH,或者-CH2CH3、-OOCH,各有邻、间、对3种,含有3个取代基为2个-CH3、-OOCH,2个-CH3有邻、间、对3种,对应-OOCH位置分别有2种、3种、1种,符合条件的同分异构体共有14种,其中核磁共振氢谱只有四组峰的同分异构体结构简式为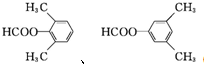 ,
,
故答案为:14;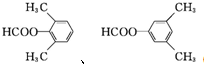 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识综合运用能力,正确判断A结构简式是解本题关键,根据分子式、结构简式解反应条件采用正逆结合的方法进行推断,难点是(5)题同分异构体种类判断,题目难度中等.

| A. | 分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种 | |
| B. | 分子式为C7H12O4,其中只含二个-COOCH3基团的同分异构体(不考虑手性异构)共有4种 | |
| C. | 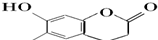 芥子醇的结构简式如图该分子中有5种官能团 芥子醇的结构简式如图该分子中有5种官能团 | |
| D. | 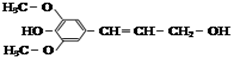 化合物如图能使酸性高锰酸钾溶液褪色,且1mol最多可与4mol氢气发生反应 |
| A. | 84消毒液具有碱性,可用作消毒剂和漂白剂 | |
| B. | 氢氟酸具有酸性,可用于玻璃的腐蚀剂 | |
| C. | 过氧化钠具有漂白性,可作航空和潜水的供氧剂 | |
| D. | 活性铁粉具有还原性,在食品袋中可用作除氧剂 |
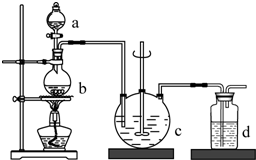 硫代硫酸钠(Na2S2O3),俗名海波、大苏打.通常为无色晶体,易溶于水,难溶于酒精,受热、遇酸易分解.医学上用于抢救氰化物中毒,常用于碘化法的测量.工业制备的反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
硫代硫酸钠(Na2S2O3),俗名海波、大苏打.通常为无色晶体,易溶于水,难溶于酒精,受热、遇酸易分解.医学上用于抢救氰化物中毒,常用于碘化法的测量.工业制备的反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:(1)c中试剂为硫化钠溶液和碳酸钠溶液.
(2)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物是硫或S.
(3)实验中要控制SO2生成速率,可采取的措施有控制反应温度、调节酸的滴加速度或调节酸的浓度等(写出一条).
(4)控制c中的溶液的pH接近7,停止通入SO2.若未控制好,导致溶液pH<7,会影响产率,原因是(用离子方程式表示)S2O32-+2H+=S↓+H2O+SO2↑.
(5)d装置盛放的氢氧化钠溶液的作用是吸收SO2等尾气,防止污染空气.
(6)停止通入SO2后,向c中加入适量的氢氧化钠溶液,将溶液转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为(填化学式)CH3CH2OH、C2H5OH或者C2H6O.
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL0.01mol/LKIO3溶液,并加入过量的KI酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时达到滴定终点.实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
A.滴定终点时仰视读数
B.锥形瓶用蒸馏水润洗
C.滴定管未用Na2S2O3溶液润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡.
| A. | D、E两种元素仅可组成化学式为E2D的化合物 | |
| B. | 原子半径:E>F>C>D | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性:D>C>F>B |
| A. | 向苯中加入浓溴水和铁粉,加热,再加入AgNO3溶液,产生沉淀,说明苯和浓溴水发生了取代反应 | |
| B. | 实验室制备的乙炔气体通常具有一定的刺激性气味,依次通过NaOH溶液、浓硫酸洗气,获得纯净的乙炔 | |
| C. | 向2%的AgNO3溶液中逐滴滴加2%的氨水,直至产生的白色沉淀恰好消失,即配制得到银氨溶液 | |
| D. | 向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应 |
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$ SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |

(1)仪器A冷却水的进水口为a(填“a”或“b”).
(2)仪器B中盛放的药品是碱石灰.
(3)实验时,装置丁中发生反应的离子方程式为ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(4)装置丙的作用为除去Cl2中的HCl,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为SO2Cl2+2H2O═H2SO4+2HCl.
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H═H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸.
①从分解产物中分离出硫酰氯的方法是蒸馏.
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红;再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4.或取反应后的产物直接加BCl2溶液,有白色沉淀,再滴加紫色石蕊试液变红,说明含有H2SO4.
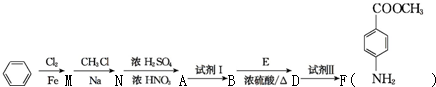
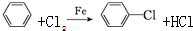
 苯胺(弱碱性,易氧化)
苯胺(弱碱性,易氧化)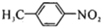 .
.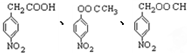 任意2种.
任意2种.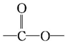 结构.
结构.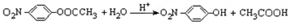 .
.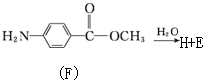 化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.请写出该缩聚反应的化学方程式
化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域.请写出该缩聚反应的化学方程式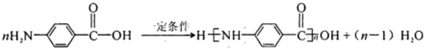 .
.