��Ŀ����
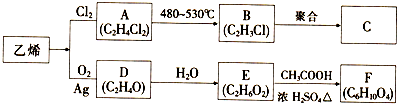
11��ij�����廯����A�ķ����к���C��H��O��N����Ԫ�أ���ͬ״���£����������ܶ�Ϊ�����ܶȵ�68.5�������Ա�Ϊԭ�Ϻϳ�A���������Ƶ�F��һ��Ⱦ���м��壩��ת����ϵ���£���һЩ����Ҫ��������ȥ��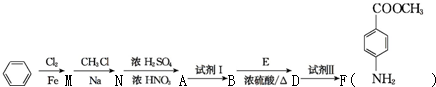
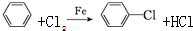
��֪������R-Cl+2Na+Cl-R���R-R��+2NaCl��R��R��Ϊ������
����
����
 �����������ԣ���������
�����������ԣ�����������ش��������⣺
��1��д��A�ķ���ʽC7H7NO2��A�Ľṹ��ʽ
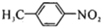 ��
����2��N��A�ķ�Ӧ������ȡ����Ӧ��
��3��������ת�����Լ�I���Լ���ֱ��ǣ��Լ�Ia���Լ���b��ѡ����ĸ����
a��KMnO4��H+����������b��Fe/���ᡡ������c��NaOH��Һ
��������ת��������A�������Լ�II���Լ�I��������E��Ũ����/�������ã��ܷ�õ�F��Ϊʲô��
��4���ú˴Ź���������֤��������E�к���2�ִ��ڲ�ͬ��ѧ�������⣮
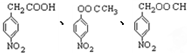
��5��д��ͬʱ��������Ҫ�������D��ͬ���칹��Ľṹ��ʽ
 ����2�֣�
����2�֣������ڷ����廯�������������������Ϊ��λ��ȡ����������һ��ȡ������������
�ڷ����к���
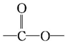 �ṹ��
�ṹ����6����һ��D��ͬ���칹��W��������������ˮ��ɵõ�һ������FeCl3��Һ������ɫ��Ӧ�IJ��д��W������������ˮ��Ļ�ѧ����ʽ
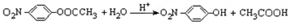 ��
����7��F��ˮ�ⷴӦ���£�
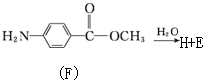 ������H��һ�������¾����۷�Ӧ���Ƶø߷�����ά���㷺����ͨѶ�����������������д�������۷�Ӧ�Ļ�ѧ����ʽ
������H��һ�������¾����۷�Ӧ���Ƶø߷�����ά���㷺����ͨѶ�����������������д�������۷�Ӧ�Ļ�ѧ����ʽ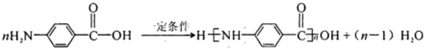 ��
��
���� ������������ȡ����Ӧ����MΪ ���ȱ���һ�ȼ��鷢����Ϣi�ķ�Ӧ����NΪ
���ȱ���һ�ȼ��鷢����Ϣi�ķ�Ӧ����NΪ ���ױ�����������Ӧ����A��A���ܶ�Ϊ�����ܶȵ�68.5������N����Է�������Ϊ68.5��2=133����AΪһ����ȡ��������ת����ϵ��F�Ľṹ��֪��AΪ
���ױ�����������Ӧ����A��A���ܶ�Ϊ�����ܶȵ�68.5������N����Է�������Ϊ68.5��2=133����AΪһ����ȡ��������ת����ϵ��F�Ľṹ��֪��AΪ ��A�����Ը��������������BΪ
��A�����Ը��������������BΪ ����F�Ľṹ��֪��B��״���Ũ���������·�Ӧ����DΪ
����F�Ľṹ��֪��B��״���Ũ���������·�Ӧ����DΪ ����EΪ�״���D��HCl/Fe������ԭ��Ӧ����F��
����EΪ�״���D��HCl/Fe������ԭ��Ӧ����F��
��� �⣺������������ȡ����Ӧ����MΪ ���ȱ���һ�ȼ��鷢����Ϣi�ķ�Ӧ����NΪ
���ȱ���һ�ȼ��鷢����Ϣi�ķ�Ӧ����NΪ ���ױ�����������Ӧ����A��A���ܶ�Ϊ�����ܶȵ�68.5������N����Է�������Ϊ68.5��2=133����AΪһ����ȡ��������ת����ϵ��F�Ľṹ��֪��AΪ
���ױ�����������Ӧ����A��A���ܶ�Ϊ�����ܶȵ�68.5������N����Է�������Ϊ68.5��2=133����AΪһ����ȡ��������ת����ϵ��F�Ľṹ��֪��AΪ ��A�����Ը��������������BΪ
��A�����Ը��������������BΪ ����F�Ľṹ��֪��B��״���Ũ���������·�Ӧ����DΪ
����F�Ľṹ��֪��B��״���Ũ���������·�Ӧ����DΪ ����EΪ�״���D��HCl/Fe������ԭ��Ӧ����F��
����EΪ�״���D��HCl/Fe������ԭ��Ӧ����F��
��1�������Ϸ�����֪AΪ ������ʽΪC7H7NO2��
������ʽΪC7H7NO2��
�ʴ�Ϊ��C7H7NO2�� ��
��
��2��NΪ ����Ũ���������������ᷢ��ȡ����Ӧ����
����Ũ���������������ᷢ��ȡ����Ӧ���� ��
��
�ʴ�Ϊ��ȡ����Ӧ��
��3�����������Ϣ������Ϸ�����֪�Լ�I���Լ���ֱ���KMnO4��H+����Fe/���ᣬ
�ʴ�Ϊ��a��b��
�����Ȼ�ԭ����������ԭ���ɵİ����ֱ����������Բ��ܵõ�F��
�ʴ�Ϊ�������Ȼ�ԭ����������ԭ���ɵİ����ֱ�������
��4��EΪCH3OH���������ֲ�ͬ��Hԭ�ӣ��ʴ�Ϊ��2��
��5��DΪ ��D��ͬ���칹������ڷ����廯�����������������Ϊ��λ��ȡ����������һ��ȡ�������������ҷ����к���
��D��ͬ���칹������ڷ����廯�����������������Ϊ��λ��ȡ����������һ��ȡ�������������ҷ����к��� �ṹ��ͬ���칹���У�
�ṹ��ͬ���칹���У� ��
��
�ʴ�Ϊ�� ����2�֣�
����2�֣�
��6��D��ͬ���칹��W��������������ˮ��ɵõ�һ������FeCl3��Һ������ɫ��Ӧ�IJ��˵����������к��з��ǻ���WΪ����������ӦΪ ��ˮ��ķ���ʽΪ��
��ˮ��ķ���ʽΪ��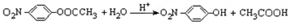 ��
��
�ʴ�Ϊ��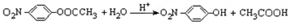 ��
��
��7��F��ˮ�����Ϊ ��CH3OH��������H��һ�������¾����۷�Ӧ���Ƶø߷�����ά���㷺����ͨѶ�����������������HΪ
��CH3OH��������H��һ�������¾����۷�Ӧ���Ƶø߷�����ά���㷺����ͨѶ�����������������HΪ ���ɷ������۷�Ӧ������ʽΪ��
���ɷ������۷�Ӧ������ʽΪ��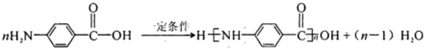 ��
��
�ʴ�Ϊ��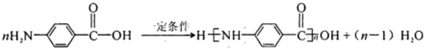 ��
��
���� ���⿼���л�����ƶϺͺϳɣ��ؼ������������Ϣ��ע���л�������ŵ����ʺͱ仯���ϺõĿ���ѧ������ѧ���������������������ȵ����ͣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | ������������ʱ�������¶ȣ�������߷�Ӧ��Ļ���Ӱٷ��� | |
| B�� | ������������ʱ������Ӧ���Ũ�ȣ�������߷�Ӧ��Ļ���Ӱٷ��� | |
| C�� | �����¶Ȳ��䣬��ѧƽ�������ƶ�ʱ����ѧƽ�ⳣ�����������ƶ�ʱ���С | |
| D�� | ������������ʱ�������Ч��������������ѧ��Ӧ���ʺͷ�Ӧ���ת���� |
���������繤ҵ����̼���Ƶķ�����·������N��Leblanc���������������£�
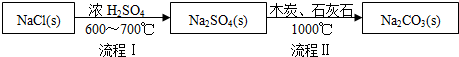
��1������I����һ������HCl�����̢�ķ�Ӧ�ֲ����У�a��Na2SO4+4C $\frac{\underline{\;1000��\;}}{\;}$ Na2S+4CO����
b��Na2S��ʯ��ʯ�������ֽⷴӦ���ܷ�Ӧ����ʽ�ɱ�ʾΪNa2SO4+4C+CaCO3$\frac{\underline{\;1000��\;}}{\;}$Na2CO3+CaS+4CO����
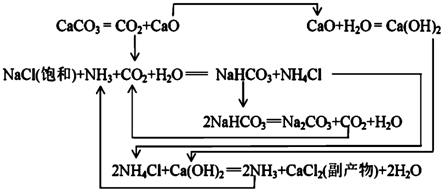
��1862�꣬����ʱ������ά��Ernest Solvay���ð������̼���ƣ���Ӧԭ�����£�
20��ʱһЩ������ˮ�е��ܽ��/g•��100gH2O��-1
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
��3������NaCl��ҺͨNH3��CO2������NaHCO3��ԭ���У���Ӧ��ϵ��NaHCO3�ܽ����С����Ӧ����ˮ��NaHCO3��Է����������
���ҹ�����ר�Һ�°��о��������Ƽ���䷴Ӧԭ���Ͱ�����ƣ������ư����Ƽ����ϣ������ԭ�������ʣ�
��4����������������NaHCO3�����õ���Һ�м���NaCl���岢ͨ��NH3����0��10�棨���¶ȷ�Χ��������NH4Cl�����ѧʽ��

 ��
��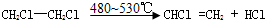 ��
��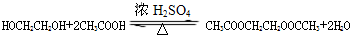 ��
��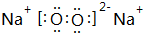 ��Z�Ļ�ѧʽΪSiO2��
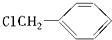
��Z�Ļ�ѧʽΪSiO2��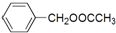 �����е�һ�֣������Դ���������ȡ��Ҳ�����üױ����Ҵ�Ϊԭ�Ͻ����˹��ϳɣ�һ�ֺϳ�·�����£�
�����е�һ�֣������Դ���������ȡ��Ҳ�����üױ����Ҵ�Ϊԭ�Ͻ����˹��ϳɣ�һ�ֺϳ�·�����£�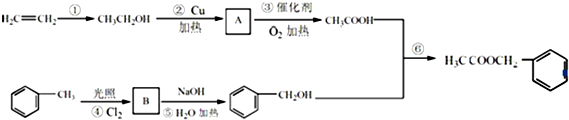
 ��
��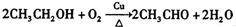 ��
��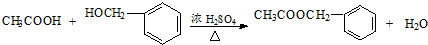 ��
��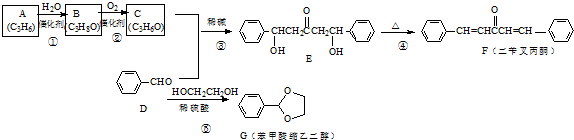
 ��A�Ӿ۲���Ľṹ��ʽ��
��A�Ӿ۲���Ľṹ��ʽ��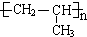 ��
��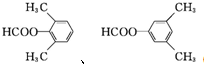 ��
��
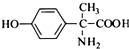
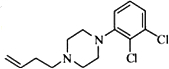
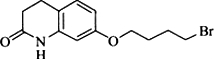 ���京�����������ļ����Ѽ���д���ƣ���
���京�����������ļ����Ѽ���д���ƣ���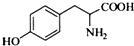 ��
��
 д����C�Ʊ�������
д����C�Ʊ������� �ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�CH3CH2OH$��_{170��}^{Ũ����}$H2C$\stackrel{Br_{2}}{��}$
�ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�CH3CH2OH$��_{170��}^{Ũ����}$H2C$\stackrel{Br_{2}}{��}$