题目内容
5.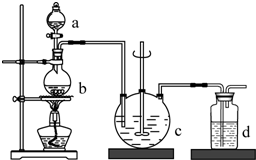 硫代硫酸钠(Na2S2O3),俗名海波、大苏打.通常为无色晶体,易溶于水,难溶于酒精,受热、遇酸易分解.医学上用于抢救氰化物中毒,常用于碘化法的测量.工业制备的反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
硫代硫酸钠(Na2S2O3),俗名海波、大苏打.通常为无色晶体,易溶于水,难溶于酒精,受热、遇酸易分解.医学上用于抢救氰化物中毒,常用于碘化法的测量.工业制备的反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:(1)c中试剂为硫化钠溶液和碳酸钠溶液.
(2)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物是硫或S.
(3)实验中要控制SO2生成速率,可采取的措施有控制反应温度、调节酸的滴加速度或调节酸的浓度等(写出一条).
(4)控制c中的溶液的pH接近7,停止通入SO2.若未控制好,导致溶液pH<7,会影响产率,原因是(用离子方程式表示)S2O32-+2H+=S↓+H2O+SO2↑.
(5)d装置盛放的氢氧化钠溶液的作用是吸收SO2等尾气,防止污染空气.
(6)停止通入SO2后,向c中加入适量的氢氧化钠溶液,将溶液转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为(填化学式)CH3CH2OH、C2H5OH或者C2H6O.
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL0.01mol/LKIO3溶液,并加入过量的KI酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时达到滴定终点.实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
A.滴定终点时仰视读数
B.锥形瓶用蒸馏水润洗
C.滴定管未用Na2S2O3溶液润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡.
分析 根据实验原理可知装置b为二氧化硫的制取,制取二氧化硫的原料为:亚硫酸钠和70%的浓硫酸;c装置为Na2S2O3的生成装置;d装置为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体,
(1)c装置为Na2S2O3的生成装置,根据2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,所需试剂为硫化钠溶液和碳酸钠溶液;
(2)二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3;
(3)影响化学反应速率的因素的因素有浓度、温度、滴加速度等.在实验中要控制SO2生成速率,可以采取的措施有控制反应温度、调节酸的滴加速度或调节酸的浓度等;
(4)硫代硫酸钠在酸性溶液中会发生氧化还原反应生成S、SO2和水;
(4)由于硫代硫酸钠易溶于水,难溶于酒精,受热、遇酸易分解,所以d中的溶液应该显碱性;
(5)d装置为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体;
(6)由于硫代硫酸钠易溶于水,难溶于酒精,所以洗涤晶体所用的试剂为酒精;
(7)根据表中数据可知第三次实验的数据误差太大,舍去,因此消耗Na2S2O3溶液体积的平均值=(19.98ml+20.02ml)÷2=20.00ml.根据反应式5I-+IO3-+6H+=3I2+3H2O、I2+2S2O32-=2I-+S4O62-建立关系式:KIO3~6 Na2S2O3,根据碘酸根离子的物质的量求出Na2S2O3的物质的量浓度,求出250mL溶液中Na2S2O3晶体的质量,与总质量5g相比得纯度;
A.滴定终点时仰视读数,使Na2S2O3溶液体积偏大;
B.锥形瓶用蒸馏水润洗,对实验结果没影响;
C.滴定管末用Na2S2O3溶液润洗,则Na2S2O3溶液会被稀释;
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡,使读出的Na2S2O3的体积变小.
解答 解:根据实验原理可知装置b为二氧化硫的制取,制取二氧化硫的原料为:亚硫酸钠和70%的浓硫酸;c装置为Na2S2O3的生成装置;d装置为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体,
(1)c装置为Na2S2O3的生成装置,根据2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,所需试剂为硫化钠溶液和碳酸钠溶液;
故答案为:硫化钠和碳酸钠的混合溶液;
(2)二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3,c中先有浑浊产生,后又变澄清,此浑浊物为S,
故答案为:硫或S;
(3)在实验中要控制SO2生成速率,可以采取的措施有控制反应温度、调节酸的滴加速度或调节酸的浓度等,
故答案为:控制反应温度、调节酸的滴加速度或调节酸的浓度等;
(4)由于硫代硫酸钠在酸性溶液中会发生氧化还原反应生成S、SO2和水,离子方程式为:S2O32-+2H+=S↓+H2O+SO2↑,所以若未控制好,pH<7时会影响产率,
故答案为:S2O32-+2H+=S↓+H2O+SO2↑;
(5)d装置为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体,故氢氧化钠溶液的作用为吸收SO2等尾气,防止污染空气,
故答案为:吸收SO2等尾气,防止污染空气;
(6)由于硫代硫酸钠易溶于水,难溶于酒精,所以洗涤晶体所用的试剂为酒精,化学式为CH3 CH2OH、C2H5OH 或者C2H6O,
故答案为:CH3 CH2OH、C2H5OH 或者C2H6O
(7)根据表中数据可知第三次实验的数据误差太大,舍去,因此消耗Na2S2O3溶液体积的平均值=(19.98ml+20.02ml)÷2=20.00ml.根据反应式5I-+IO3-+6H+=3I2+3H2O、I2+2S2O32-=2I-+S4O62-建立关系式:KIO3~6Na2S2O3,则20ml溶液中Na2S2O3的物质的量是:0.025L×0.01mol/L×6=0.0015mol,则原溶液中Na2S2O3的物质的量是0.0015mol×250/20=0.01875mol,质量是0.01875mol×158g/mol=2.9625g,因此该产品的纯度是 $\frac{2.9625g}{5.0g}$×100%=59.3%;
A.滴定终点时仰视读数,则读数偏大,因此消耗Na2S2O3溶液的体积增加,所以测定结果偏低,故A正确;
B.锥形瓶用蒸馏水润洗不会影响实验结果,故B错误;
C.滴定管未用Na2S2O3溶液润洗,则溶液浓度降低,因此实际消耗Na2S2O3溶液的体积增加,所以测定结果偏低,故C正确;
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡,则消耗Na2S2O3溶液的体积减小,所以测定结果偏高,故D错误;
故选:59.3%;AC.
点评 本题主要考查物质制备实验方案设计与探究,涉及物质的性质与现象、化学方程式的书写以及氧化还原滴定,注意反滴定误差分析的原理,难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 其它条件不变时,升高温度,可以提高反应物的活化分子百分数 | |
| B. | 其它条件不变时,增大反应物的浓度,可以提高反应物的活化分子百分数 | |
| C. | 保持温度不变,化学平衡正向移动时,化学平衡常数增大,逆向移动时则减小 | |
| D. | 其它条件不变时,加入高效催化剂,可以增大化学反应速率和反应物的转化率 |
①非金属置换金属的反应
②弱酸可以生成强酸的反应
③没有水生成,也没有沉淀和气体生成的复分解反应
④有单质参加的非氧化还原反应
⑤铜置换出氢气的反应.
| A. | ①②③ | B. | ①②④ | C. | ②③④⑤ | D. | ①②③④⑤ |
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法.其流程如下:

(1)流程I的另一产物是HCl,流程Ⅱ的反应分步进行:a.Na2SO4+4C $\frac{\underline{\;1000℃\;}}{\;}$ Na2S+4CO↑;
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+CaS+4CO↑.
Ⅱ.1862年,比利时人索尔维(Ernest Solvay)用氨碱法生产碳酸钠.反应原理如下:

20℃时一些物质在水中的溶解度/g•(100gH2O)-1
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大.
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在0~10℃(填温度范围)下析出NH4Cl.(填化学式)

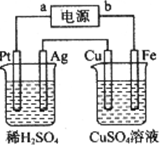
| A. | a极是直流电源的正极 | |
| B. | Fe极是阳极 | |
| C. | Pt极产生的气体体积是Ag极产生气体体积的2倍 | |
| D. | 硫酸铜溶液的浓度变大 |
 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | 有O2参加反应的a极为电池的负极 | |
| B. | 有H2参加反应的b极为电池的正极 | |
| C. | a极对应的电极反应式为O2+2H2O-4e═4OH- | |
| D. | 该电池的总反应方程式为:2H2+O2═2H2O |
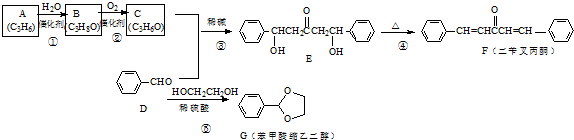
 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
 ;
; ,
, ;
;
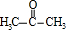 ;A加聚产物的结构简式是
;A加聚产物的结构简式是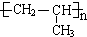 .
. .
.