题目内容
14.如图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为Cl2、E为Fe单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.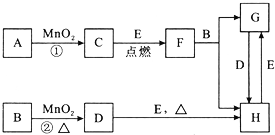
(1)写出有关物质的化学式:
BHCl,FFe3O4,HFeCl3.
(2)指出MnO2在相关反应中的作用:反应①中是催化剂,反应②中是氧化剂.
(3)若反应①是在加热条件下进行,则A是KClO3;若反应①是在常温条件下进行,则A是H2O2.
(4)写出B与MnO2共热生成D的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑.
分析 D为黄绿色气体,则D为Cl2,B与二氧化锰在加热条件下生成氯气,则B为浓盐酸,反应中二氧化锰其氧化剂作用,C为O2,若反应①是在加热条件下进行,则A是KClO3,若反应①是在常温条件下进行,则A为H2O2,E为Fe,F为Fe3O4,G为FeCl2,H为FeCl3,结合物质的性质解答该题.
解答 解:D为黄绿色气体,则D为Cl2,B与二氧化锰在加热条件下生成氯气,则B为浓盐酸,反应中二氧化锰其氧化剂作用,C为O2,若反应①是在加热条件下进行,则A是KClO3,若反应①是在常温条件下进行,则A为H2O2,E为Fe,F为Fe3O4,G为FeCl2,H为FeCl3,
(1)由以上分析可知B为HCl,F为Fe3O4,H为FeCl3,故答案为:HCl;Fe3O4;FeCl3;
(2)反应①中二氧化锰为催化剂,反应②中二氧化锰为氧化剂,故答案为:催化;氧化;
(3)反应①是二氧化锰条件下制备氧气,若反应①是在加热条件下进行,则A是KClO3,若反应①是在常温条件下进行,则A为H2O2,故答案为:KClO3;H2O2;
(4)B与MnO2共热获得D的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑.
点评 本题考查无机物的推断,为高频常见题型,侧重于学生的分析能力的考查,注重物质性质的综合应用,题目难度不大,本题注意二氧化锰的作用判断和反应特征,注意从化合价的变化角度分析.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
4.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 为延长食品保质期,可向其中大量添加苯甲酸钠等防腐剂 | |
| B. | 催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 以树皮和麻绳为原料所造的纸张其主要成分是纤维素,但纤维素与淀粉不是同分异构体 |
1.下列有关物质的性质与应用均正确的是( )
| A. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| B. | 乙烯能使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同 | |
| C. | Mg(OH)2难溶于水,但可缓慢溶于浓的NH4Cl溶液 | |
| D. | 油脂在酸性条件下可以水解,可用此反应可以制作肥皂 |
 .
. .
. (填结构简式)
(填结构简式)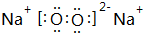 ;Z的化学式为SiO2.
;Z的化学式为SiO2.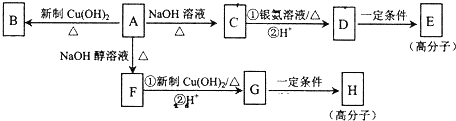
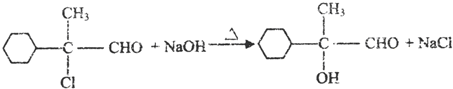 .
. ,E的结构简式是
,E的结构简式是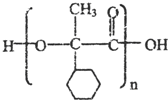 .
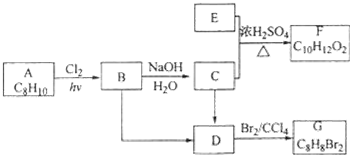
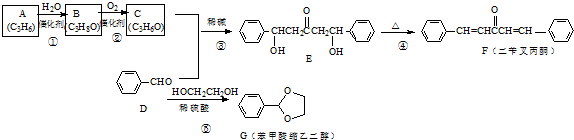
. 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
 ;
; ,
, ;
;
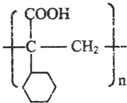
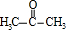 ;A加聚产物的结构简式是
;A加聚产物的结构简式是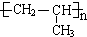 .
.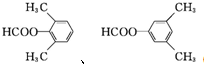 .
.